
| A. | 3.12g | B. | 3.9g | C. | 0.78g | D. | 2.34g |
分析 AlCl3的物质的量为:0.02L×2mol/L=0.04mol,NaOH的物质的量为:0.03L×5mol/L=0.15mol,根据反应AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O判断反应过量问题,进而计算得到沉淀的质量.
解答 解:AlCl3的物质的量为:0.02L×2mol/L=0.04mol,NaOH的物质的量为:0.03L×5mol/L=0.15mol,则:
AlCl3+3NaOH=Al(OH)3↓+3NaCl
0.04mol 0.12mol 0.04mol
Al(OH)3+NaOH=NaAlO2+2H2O
0.03mol (0.15-0.0.12)mol
则最后得到的沉淀的质量为:0.04mol-0.03mol=0.01mol,
所以生成白色沉淀的质量为:0.01mol×78g/mol=0.78g,
故选C.
点评 本题考查化学方程式的计算、过量问题的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握根据反应物物质的量判断过量情况的方法,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
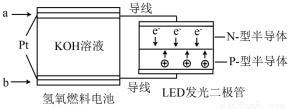
| A. | P一型半导体连接的是电池负极 | |
| B. | b 处通入O2为电池正极,发生了还原反应 | |
| C. | 通入O2的电极发生反应:O2+4e-+4H+=2H2O | |
| D. | 该装置只涉及两种形式的能量转换 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 质量数是3 | B. | 质子数是3 | C. | 中子数是1 | D. | 电子数是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com