
【题目】草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性。向10mL 0.01mol·L-1的H2C2O4溶液滴加0.01mol·L-1KOH溶液V(mL),回答下列问题。
(1)当V<10mL时,反应的离子方程式为___。
(2)当V=10mL时,溶液中HC2O4-、C2O42-、H2C2O4、H+的浓度从大到小的顺序为___。
(3)当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42-)+(HC2O4-);当V=b mL时,溶液中离子浓度有如下关系:c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4);则a___b(填“<”“=”或“>”)。
(4)当V=20mL时,再滴入NaOH溶液,则溶液中![]() 的值将___(填“变大”“变小”或“不变”)。
的值将___(填“变大”“变小”或“不变”)。
【答案】H2C2O4+OH-=HC2O4-+H2O c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4) > 变小
【解析】
①草酸是二元酸,其和KOH的反应,是分步的:KOH+H2C2O4=KHC2O4+H2O,KOH+KHC2O4=K2C2O4+H2O;当第一步反应中,KOH过量时,剩余的KOH才会进行第二步反应;②KHC2O4溶液呈酸性,说明HC2O4-的电离程度大于水解程度;据此答题。
(1)当V<10mL时,n(KOH)<0.01L×0.01mol·L-1=n(H2C2O4),则发生反应KOH+H2C2O4=KHC2O4+H2O,离子方程式为H2C2O4+OH-=HC2O4-+H2O;
(2)当V=10mL时,溶液中的溶质为KHC2O4,由于KHC2O4溶液呈酸性,即HC2O4-的电离程度大于水解程度,所以KHC2O4溶液中,c(HC2O4-)>c(H+)>c(C2O42-)>c(H2C2O4);
(3)溶液中,电荷守恒式为c(H+)+c(K+)=2c(C2O42-)+(HC2O4-)+c(OH-),若c(K+)=2c(C2O42-)+(HC2O4-),则c(H+)= c(OH-),此时V=a mL,则a>10;在KHC2O4溶液中有c(K+)= c(C2O42-)+c(HC2O4-)+c(H2C2O4),即V=b mL=10mL;所以a>b;
(4)V=20mL时,溶液中的溶质只有K2C2O4,溶液中存在水解平衡,主要为:C2O4-+H2O![]() HC2O4-+OH-,再滴入NaOH溶液,该水解平衡向左移动,即n(C2O42-)增大,n(K+)不变,所以
HC2O4-+OH-,再滴入NaOH溶液,该水解平衡向左移动,即n(C2O42-)增大,n(K+)不变,所以![]() 减小。
减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】向容积均为0.5L的甲、乙、丙三个密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)![]() 2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
2C(g)。各容器的反应温度、反应物起始量,反应过程中C的浓度随时间变化关系分别如图表所示:
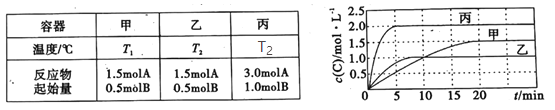
下列说法正确的是( )
A.T1< T2,且该反应为吸热反应
B.x=2
C.若平衡后保持温度不变,改变容器体积平衡不移动
D.该反应正反应的活化能大于逆反应的活化能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应不可能自发进行的是
A.2O3(g)=3O2(g) △H<0
B.CaCO3(s)=CaO(s)+CO2(g) △H>0
C.N2(g)+3H2(g) ![]() 2NH3(g) △H<0
2NH3(g) △H<0
D.2CO(g)=2C(s)+O2(g) △H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填空
(1)![]() 的名称是 ______ ;
的名称是 ______ ;
(2)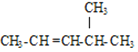 的名称是 ______ ;
的名称是 ______ ;
(3) 的含氧官能团的名称___________________________________
的含氧官能团的名称___________________________________
(4)实验测定某有机物元素质量组成为C:69% H:4.6% N:8.0%,其余是O,该有机物的实验式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】软锰矿的主要成分MnO2,还含有Fe2O3、Al2O3、SiO2等,用软锰矿浆吸收工业废气中的二氧化硫,制备高锰酸钾的流程如图所示:
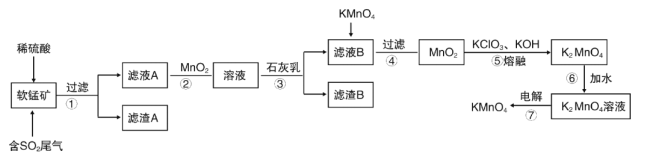
已知:滤液A中的金属阳离子主要是Mn2+还含有少量的Fe2+、Al3+等,几种离子开始沉淀和完全沉淀时的pH如右表所示:
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe2+ | 7.6 | 9.7 |
Fe3+ | 2.7 | 3.7 |
Al3+ | 3.8 | 4.7 |
Mn2+ | 8.3 | 9.8 |
根据上述流程,回答下列问题:
(1)写出软锰矿通入二氧化硫发生的主要反应的化学方程式__。
(2)滤渣A的成分是__,其中的化学键类型是___。
(3)步骤②中加入MnO2的作用__。
(4)有同学认为可以用碳酸锰(MnCO3)或氢氧化锰[Mn(OH)2]替代石灰乳,你是否同意此观点___?简述理由___。
(5)滤液B中加入KMnO4时发生反应的离子方程式是__。
(6)第⑦步用镍片(镍不参与反应)和铁板作电极,电解K2MnO4溶液可制备KMnO4。有关说法正确的是__(填字母)

A.a与电源的负极相连
B.离子交换膜为阳离子交换膜
C.阳极的电极反应为MnO42--e-=MnO4-
D.阴极的电解产物为KOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
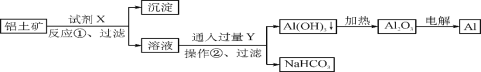
下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。
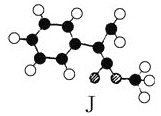
试回答下列问题。
(1)肉桂酸甲酯的结构简式为__________________。
(2)在苯环上的一氯代物有________种。
(3)写出该肉桂酸甲酯在氢氧化钠溶液中水解的化学方程式:_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应中反应物与生成物FeCl2、FeCl3、CuCl2、Cu;
(1)将上述反应设计成的原电池如图甲所示请回答下列问题:

①图中X溶液是__;
②Cu电极上发生的电极反应式为__;
③原电池工作时,盐桥中的__填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示乙烧杯中金属阳离子的物质的量与电子转移的物质的量的变化关系如图丙,请回答下列问题:
①M是电源的__极;
②图丙中的②线是__的变化;
③当电子转移为0.2mol时向乙烧杯中加入__L5mol/LNaOH溶液才能使所有的金属阳离子沉淀完全。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述中一定正确的是![]()
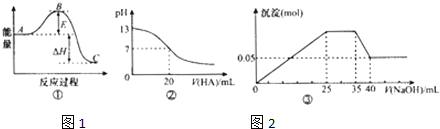
A.若图①中曲线表示![]() ,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
,反应过程的能量变化.则升温或使用催化剂,均会使B点降低,反应速率加快
B.图②可表示![]() 时,用
时,用![]() 的
的![]() 溶液滴定20mL
溶液滴定20mL![]() NaOH溶液,溶液的pH随加入的酸的体积的变化情况
NaOH溶液,溶液的pH随加入的酸的体积的变化情况
C.若图③表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则使用的NaOH溶液的浓度为![]()
D.若图④表示向含![]() 、
、![]() 、
、![]() 、
、![]() 的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则
的溶液中滴加NaOH溶液时,沉淀量随NaOH溶液加入量的变化情况,则![]() :
:![]()
![]() :
:![]() :3:2
:3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com