
 .
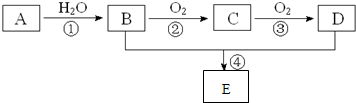
.分析 A是一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1,则C、H原子个数比是1:2,所以最简式是CH2,最简式的式量是14,A的相对分子质量小于30,则A是CH2=CH2;A与水发生加成反应生成B为CH3CH2OH;B被催化氧化产生C为CH3CHO;C被催化氧化产生D为CH3COOH;乙醇与乙酸发生酯化反应产生乙酸乙酯CH3COOCH2CH3,据此分析解答.
解答 解:A是一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1,则C、H原子个数比是1:2,所以最简式是CH2,最简式的式量是14,A的相对分子质量小于30,则A是CH2=CH2;A与水发生加成反应生成B为CH3CH2OH;B被催化氧化产生C为CH3CHO;C被催化氧化产生D为CH3COOH;乙醇与乙酸发生酯化反应产生乙酸乙酯CH3COOCH2CH3,
(1)A是乙烯,其电子式为 ,故答案为:
,故答案为: ;
;
(2)B为CH3CH2OH、D为CH3COOH,BD中官能团名称分别是羟基、羧基,故答案为:羟基;羧基;
(3)①④反应类型分别是加成反应、取代反应或酯化反应,
故答案为:加成反应;取代反应(或酯化反应);
(4)①为乙烯和水的加成反应,生成乙醇,反应方程式为CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3CH2OH
,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$ CH3CH2OH;
②为乙醇的催化氧化反应,反应方程式为2CH3CHOH+O2$→_{△}^{Cu}$ 2CH3CHO+2H2O,
故答案为:2CH3CHOH+O2$→_{△}^{Cu}$ 2CH3CHO+2H2O;
④为乙酸和乙醇的酯化反应,反应方程式为CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O,
故答案为:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$ CH3COOCH2CH3+H2O.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断能力,明确物质中官能团性质及物质之间转化关系是解本题关键,会正确书写方程式,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 30 mol、30 mol | B. | 10 mol、10 mol | C. | 7.5 mol、7.5 mol | D. | 2.5 mol、2.5 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100 mL量筒量取5.26 mL稀硫酸溶液 | |
| B. | 用托盘天平称取11.7 g CuO粉末 | |
| C. | 用广泛pH试纸测得溶液的pH为3.5 | |
| D. | 温度计上显示的室温读数为25.68 oC |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量酸雨于A、B两支洁净试管中,待用. | / |
| 步骤2:往A试管中加入过量的Ba(OH)2溶液,静置,过滤. | / |
| 步骤3:取少量步骤2得到的滤渣,加入盐酸. | |
| 步骤4: | |
| 步骤5: |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com