
一定条件下化学反应:CO2(g)+H2(g)  CO(g)+H2O(g),的化学平衡常数K=1,相同条件下,当C(CO2)=0.5mol·L-1、C(H2)=0.5mol·L-1、C(CO)=1mol·L-1、C(H2O)=1mol·L-1时,下列说法正确的是
CO(g)+H2O(g),的化学平衡常数K=1,相同条件下,当C(CO2)=0.5mol·L-1、C(H2)=0.5mol·L-1、C(CO)=1mol·L-1、C(H2O)=1mol·L-1时,下列说法正确的是
A.处于平衡状态,正逆反应速率相等
B.平衡逆移,正反应速率小于逆反应速率
C.CO2的转化率为50%
D.该条件下,学平衡常数K=4
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年吉林省高二上11月月考化学试卷(解析版) 题型:填空题
下表是某地区市场上销售的一种“加碘食盐”包装袋上的部分文字说明。请根据此表,结合化学和生物学科的知识,回答下列问题。
配料表 | 精制海盐、碘酸钾 |
含碘量 | 20~40 mg / kg |
卫生许可证号 | ××卫碘字(1999)第001号 |
分装日期 | 见封底 |
储藏方法 | 密封、避光、防潮 |
食用方法 | 烹调时,待食品熟后加入碘盐 |
(1)要在食盐中加碘,是因为碘是人体内合成___________激素的主要原料,缺碘会引起疾病。
(2)食盐中加碘,这里碘指的是___________(填化学式);,其中碘元素的化合价为___________。
(3)根据含碘盐的食用方法可推测碘元素的化学性质,碘酸钾在受热时容易___________。
(4)辨别真假碘盐时,可将盐溶于水,加入KI溶液和少量白醋,再加淀粉溶液。以下判断正确的是( )
A.如显出绿色,是真碘盐 B.如显出红色,是真碘盐
C.如显出蓝色,是真碘盐 D.如显出黄色,是真碘盐
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
有关Na2CO3与NaHCO3的性质,以下叙述正确的是
A.将石灰水加入NaHCO3溶液中不产生沉淀,加入Na2CO3溶液中产生白色沉淀
B.向Na2CO3溶液中逐滴加入等物质的量的稀盐酸,生成的CO2与原Na2CO3物质的量之比为1:2
C.等质量的NaHCO3和Na2 CO3分别与足量的盐酸反应,在同温同压下,生成CO2的体积相同
CO3分别与足量的盐酸反应,在同温同压下,生成CO2的体积相同
D.向Na2CO3饱和溶液中通入CO2有NaHCO3晶体析出
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏银川市高一上学期期中测试化学试卷(解析版) 题型:选择题
某同学想要从碘的饱和水溶液中萃取碘,关于该实验的说法中不正确的是
A、使用分液漏斗前应先检查其是否漏液
B、可以选用苯、汽油、酒精和四氯化碳为萃取剂
C、若用四氯化碳为萃取剂,将两种液体混合,充分振荡,静置,分层后,下层液体呈紫红色
D、分层后,打开分液漏斗活塞,使全部下层液体沿承接液体的烧杯内壁流出,然后上层液体从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省台州市高一上学期第一次月考化学试卷(解析版) 题型:选择题
物质发生化学变化时:①电子总数 ②原子总数 ③分子总数 ④物质的种类 ⑤物质的总质量 ⑥物质的总能量,反应前后肯定不发生变化的是
A. ①③⑤ B. ①②⑤ C. ①⑤⑥ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源:2016届广东省佛山市顺德六校高三上学期期中理综化学试卷(解析版) 题型:填空题
(1)已知H-H 键能为436 kJ·mol-1,H-N键键能为391 kJ·mol-1,根据化学方程式: N2(g)+3 H2(g) 2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
2NH3(g) ΔH=-92.4kJ·mol-1。则N≡N键的键能是_________________
(2)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是__________________。
A.C(s) + H2O(g) = CO(g) + H2(g) △H > 0
B.2H2(g)+O2(g)=2H2O(1) △H < 0
C.NaOH(aq) + HC1(aq) = NaC1(aq) + H2O(1) △H < 0
(3)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应式___________。
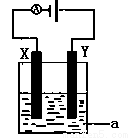
(4)电解原理在化学工业中有着广泛的应用。现将你设计的原电池通过导线与图中电解池相连,其中为 a电解液,X和Y均为惰性电极,则
①若a为CuSO4溶液,则电解时的化学反应方程式为 。
②若电解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,当阳极产生的气体672mL(标准状况下)时,溶液的pH=_______(假设电解后溶液体积不变)。
③若用此电解装置模拟工业精炼铜,则应将a改为 溶液,并将 极换成粗铜(填“X”或“Y”)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广西省高一上学期期中测试化学试卷(解析版) 题型:填空题
完成下列各题:
(1)在18.6g Fe和Zn合金中加入200mL某浓度的稀硫酸恰好完全反应,生成0.3mol H2.则原合金中有__________mol Fe,稀硫酸的物质的量浓度为__________ mol/L.
(2)已知19.2gCu与过量的200ml 5mol/L稀硝酸充分反应,反应方程式如下,请计算(忽略反应前后溶液体积的变化).3Cu+8HNO3 3Cu(NO3)2+2NO↑+4H2O
3Cu(NO3)2+2NO↑+4H2O
①转移电子的个数为__________(用NA表示阿伏加德罗常数);标准状况下,产生NO气体的体积为__________.
②反应后,H+的物质的量浓度为__________,NO3﹣的物质的量浓度为__________.
查看答案和解析>>
科目:高中化学 来源:2016届北京市高三上学期期中测试化学试卷(解析版) 题型:选择题
为实现下列实验目的,所用试剂合理的是
选项 | 实验目的 | 试剂 |
A | 验证Br2的氧化性强于I2 | 溴水、KI溶液、淀粉溶液 |
B | 除去Fe2O3中的Al2O3 | 稀盐酸 |
C | 检验Fe3O4溶于盐酸后的金属阳离子 | NaOH溶液 |
D | 制备Fe(OH)3胶体 | 饱和FeCl3溶液、NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上学期期中测试化学试卷(解析版) 题型:填空题
Al2(SO4)3的电离方程式为 ,17.1g Al2(SO4)3溶于水配成250mL溶液,SO42-的粒子数为 ,Al3+的物质的量浓度为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com