
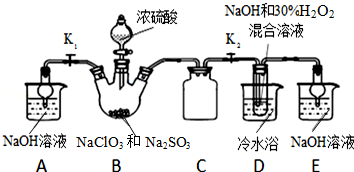
分析 (1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平书写方程式;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,注意温度控制;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl;
(5)根据化学反应可得关系式:NaClO2~2I2~4S2O32-,令样品中NaClO2的物质的量x,根据关系式计算.
解答 解:(1)装置D中发生气体反应,装置内压强降低,装置C的作用是安全瓶,防止D瓶溶液倒吸到B瓶中,
故答案为:防止D瓶溶液倒吸到B瓶中;
(2)装置B中制备得到ClO2,所以B中反应为NaClO3和Na2SO3在浓H2SO4的作用生成 ClO2和Na2SO4,反应的方程式为:2NaClO3+Na2SO3+H2SO4=2 ClO2↑+2Na2SO4+H2O;
装置D反应后的溶液获得NaClO2晶体,装置D中生成NaClO2,Cl元素的化合价降低,双氧水应表现还原性,有氧气生成,结合原子守恒可知,还有水生成,配平后方程式为:2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2,
故答案为:2NaClO3+Na2SO3+H2SO4=2ClO2↑+2Na2SO4+H2O;2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2;
(3)从溶液中制取晶体,一般采用蒸发结晶、过滤、洗涤、干燥的方法,为防止析出晶体NaClO2•3H2O,应趁热过滤,由题目信息可知,应控制温度38℃~60℃进行洗涤,低于60℃干燥,
故答案为:趁热过滤;
(4)由题目信息可知,应控制温度38℃~60℃,高于60℃时NaClO2分解成NaClO3和NaCl,所以如果撤去D中的冷水浴,可能导致产品中混有的杂质是NaClO3和NaCl,
故答案为:NaClO3和NaCl;
(5)令样品中NaClO2的物质的量x,
NaClO2~2I2~4S2O32-,
1mol 4mol
0.25x c mol•L-1×V×10-3L
则:x=c•V•10-3mol
故答案为:c•V•10-3mol.
点评 本题考查制备方案的设计与评价,题目难度中等,涉及亚氯酸钠制备实验的基本操作、亚氯酸钠的性质及中和滴定等知识,理解实验原理是解题的关键,试题侧重考查学生的分析理解能力及灵活应用能力.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
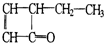 ,可表示为
,可表示为 ,某有机物
,某有机物 的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )
的多种同分异构体中,属于芳香醇的一共有(不考虑立体异构)( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常元素的化合价与其原子的质量数有密切的关系 | |
| B. | 已知铱的一种核素是${\;}_{77}^{191}$Ir,则其核内的中子数是114 | |
| C. | ${\;}_{6}^{14}$C和${\;}_{7}^{17}$N的质量数相同,但质子数不同,所以互称为同位素 | |
| D. | 钾的原子结构示意图为 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油分馏可获得汽油、煤油等矿物油,煤焦油干馏可获得苯、甲苯等有机物 | |
| B. | 使用“乙醇汽油”、“燃煤固硫”、“汽车尾气催化净化”等可提高空气质量 | |
| C. | 金刚石呈正四面体网状结构、C60呈笼状结构,这两种晶体中微粒间的作用力不完全相同 | |
| D. | 硬脂酸甘油酯在碱性条件下的水解属于皂化反应,乙酸乙酯在碱性条件下的水解不属于皂化反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com