
 与
与 反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
反应过程中能量变化的曲线图。根据图像判断下列叙述中正确的是
A.该反应的热化学方程式为:N2(g)+3H2(g) 2NH3(g)ΔH=+92kJ/mol 2NH3(g)ΔH=+92kJ/mol |
B. 曲线是加入催化剂时的能量变化曲线 曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热数值会减小 |
D.反应2NH3(g)  N2(g)+3H2(g) ΔH=+92kJ/mol N2(g)+3H2(g) ΔH=+92kJ/mol |
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源:不详 题型:计算题
 2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l)
2NH3(g) △H=-93.0kJ /mol;另据报道,一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。
4NH3(g)+3O2(g) △H=" +1530.0kJ" /mol。| A.气体体积不再变化,则已平衡 |
| B.气体密度不再变化,尚未平衡 |
| C.平衡后,往装置中通入一定量Ar,压强不变,平衡不移动 |
| D.平衡后,压缩装置,生成更多NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
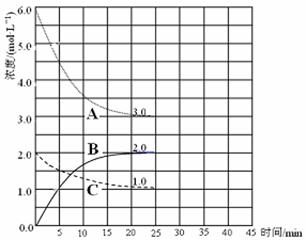
 CH3OH(g);CO的转化率与温度、压强的关系如图所示。
CH3OH(g);CO的转化率与温度、压强的关系如图所示。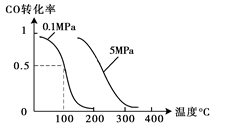
 Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。
Ag+(aq)+Cl-(aq)。25oC时,现将足量AgCl分别放入:①l00mL蒸馏水;②l0 0mL 0.2 mol?L-1AgNO3溶液;③100mL 0.1 mol?L-1氯化镁溶液;④100mL 0.1 mol?L-1氯化钠溶液。充分搅拌后,相同温度下Ag+浓度由大到小的顺序是 (填写序号)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1mol C2H2(g)完全燃烧生成气态水时放热大于1300kJ |
| B.1mol C6H6(1)完全燃烧生成液态水时放热大于3295kJ |
| C.相同条件下,等质量的C2H2(g)与C6H6(g)完全燃烧,C6H6(g)放热更多 |
| D.C2H2(g)三聚生成C6H6(g)的过程属于放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.330 kJ | B.276.67 kJ |
| C.130 kJ | D.76.67 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
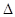 H=-67.7 kJ·mol-1
H=-67.7 kJ·mol-1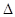 H=-57.3 kJ·mol-1
H=-57.3 kJ·mol-1A.氢氟酸的电离方程式及热效应可表示为:HF(aq) F-(aq)+H+(aq) F-(aq)+H+(aq) 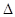 H=+10.4 kJ·mol-1 H=+10.4 kJ·mol-1 |
| B.当V=20时,溶液中:c(OH-)=c(HF)+c(H+) |
| C.当V=20时,溶液中:c(F-)<c(Na+)=0.1 mol·L-1 |
| D.当V>0时,溶液中一定存在:c(Na+)>c(F-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H =-890kJ/mol |
B. CH4(g)+O2(g)= CH4(g)+O2(g)= CO2(g)+H2O(l) △H=-445kJ/mol CO2(g)+H2O(l) △H=-445kJ/mol |
C. CO2(g)+H2O(l)= CO2(g)+H2O(l)= CH4(g)+O2(g) △H= +445kJ/mol CH4(g)+O2(g) △H= +445kJ/mol |
| D.CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H =-55.625kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com