
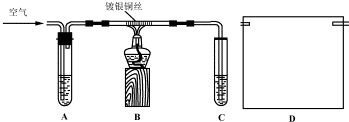
分析 (2)①该反应引发后,不需加热即可进行,说明反应是放热的;乙醇催化氧化可以生成乙醛;
②根据甲中单位时间内的气泡数来控制气流;
(3)①升高温度能促进乙醇的挥发;
②安全瓶中的导管采用“短进长出”的方式;
(4)如果在装置B、C之间不增加D装置,产物不用水吸收可以直接冷却,可常用冰水混合物来冷却.
解答 解:(2)①实验时,先加热玻璃管乙中的镀银钢丝,约1分钟后鼓入空气,此时铜丝即呈红热状态,若把酒精灯撤走,控制一定的鼓气速度,铜丝能长时间保持红热直到实验结束,说明反应引发后,不需加热即可进行到底,说明该反应是放热的反应;乙醇发生催化氧化生成乙醛和水,反应的化学方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+H2O,
故答案为:放热;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+H2O;
②甲中单位时间内的气泡数越多,气流速度越大,反之越小,可通过观察甲中单位时间内的气泡数控制气体流速,
故答案为:观察甲中单位时间内的气泡数;
(3)①乙醇具有挥发性,升高温度能促进乙醇的挥发,从而使生成乙醇蒸气的速率加快,
故答案为:使生成乙醇蒸气的速率加快;
②安全瓶中的导管是“短进长出”,装置B、C之间接上D装置为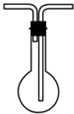 ,
,
故答案为 ;
;
(4)如果在装置B、C之间不增加D装置,产物不用水吸收可以直接冷却,可常用冰水混合物来冷却,
故答案为:将试管丁浸在冰水中,产物不用水吸收而是直接冷却.
点评 本题考查了乙醇的催化氧化实验,题目难度中等,掌握乙醇的化学性质以及乙醇的催化氧化实验操作时解答的关键,试题培养了学生的分析能力及化学实验能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 2X2+3Y2?2X2Y3 | B. | 3X2+2Y2?2X3Y2 | C. | X2+2Y22?XY2 | D. | 2X2+Y2?2X2Y |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 人类历史上使用最早的合金是青铜 | |
| B. | 目前世界上用量最大的合金是钢 | |
| C. | 改变原料的配比、改变生成合金的条件,可以得到具有不同性质的合金 | |
| D. | 一般合金的熔点高于它的各成分金属 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: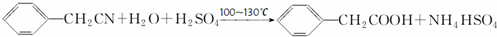 ;
;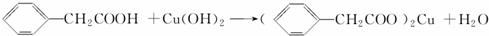
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
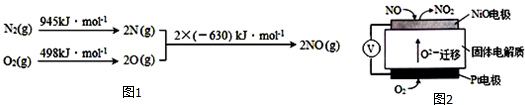
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl-→SO3-→石墨-→液氧 | B. | NaCl-→乙醇-→铁-→空气 | ||
| C. | 蔗糖-→CuSO4-→氮气-→波尔多液 | D. | KCl-→NaNO3-→氯气-→石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-93 kJ•mol-1 | |
| B. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+1471 kJ•mol-1 | |
| C. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=+93 kJ•mol-1 | |
| D. | N2(g)+3H2(g) $?_{高温高压}^{催化剂}$2NH3(g)△H=-1471 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
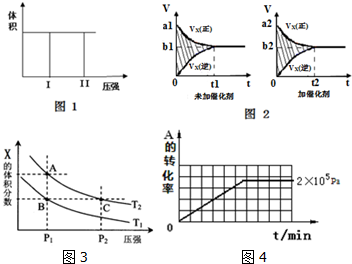
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com