
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
【答案】D
【解析】N2O和CO2的相对分子质量都是44,所以由N2O和CO2组成的混合气体的平均相对分子质量也是44。由阿伏加德罗定律可知,同温同压下,不同气体的密度之比等于其摩尔质量之比,也等于其相对分子质量之比。同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体的平均相对分子质量为22,1mol此气体质量为22g。因为C2H4和N2和的相对分子质量相等都是28,所以2n(H2)+28[1-n(H2)]=22,解之得n(H2)= ![]() mol,H2组成的混合气体中H2的质量分数为
mol,H2组成的混合气体中H2的质量分数为![]() =
=![]() 。D正确,本题选D。
。D正确,本题选D。


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案科目:高中化学 来源: 题型:
【题目】菠萝酯(F)是一种具有菠萝香味的赋香剂,其合成路线如下:


已知:(i)
(ii)
(1)A中所含官能团的名称是______________。
(2)M→N的化学方程式____________________________________
(3)N发生银镜反应的方程式_________________________________
(4)M物质环上的一氯代物有__________种
(5)1mol菠萝酯(F)与氢气反应,最多消耗氢气___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1个NH4+离子含有________个质子,________个电子。
(2)2molH3PO4含有___________个分子,_________mol O,_________个原子。
(3)含有6.02×1023个H的CH4的物质的量为________mol。
(4)含有相同氧原子数的CO、CO2、O3的物质的量之比为______________。
(5)相同物质的量的SO2和SO3,分子数之比为_________;原子数之比为_________;电子数之比为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质发生状态变化所克服的粒子间作用力属于同种类型的是
A.HCl和蔗糖溶于水B.水晶和干冰熔化
C.硫单质的升华与H2S的分解D.NaF和氧化钠分别受热熔化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(g)+5B(g)![]() 4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
4C(g)+6D(g),在5 L的密闭容器中进行,半分钟后,C的物质的量增加了0.30 mol。下列叙述正确的是( )
A. A的平均反应速率是0.010 molL﹣1s﹣1
B. 容器中含D物质的量至少为0.45 mol
C. 容器中A、B、C、D的物质的量的比一定是4∶5∶4∶6
D. 容器中A的物质的量一定增加了0.30 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是一种极具发展潜力的清洁能源。
(1)氢气的制取与储存是氢能源利用领域的研究热点.
已知:①CH4的燃烧热为890KJ·mol-1; ②H2的热值为50.2kJ·g-1
则甲烷部分氧化生成CO2和H2的热化学方程式为___________________________________;该反应自发进行的条件是___________。
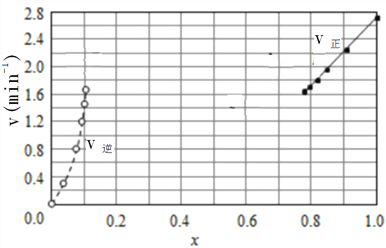
(2)Bodensteins研究了如下反应:2HI(g)![]() H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)△H=+11kJ/mol在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
X(HI) | 1.00 | 0.910 | 0.850 | 0.815 | 0.795 | 0.784 |
X(HI) | 0.00 | 0.600 | 0.730 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为:___________。
②上述反应中,正反应速率为v正=k正x2(HI),逆反应速率为v逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,若k正=9.00min-1,在t=20min时,v逆=__________min-1(保留三位有效数字)
③由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用下图表示。在上述平衡基础上,缓慢升高到某一温度,反应重新达到平衡,请在下图中画出此过程的趋势图。______________
(3)一种可超快充电的新型铝电池,充放电时AlCl4-和Al2Cl7-两种离子在Al电极上相互转化,其它离子不参与电极反应,放电时负极Al的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学实验的结果如下表:
实验序号 | 反应物 | 在相同温度下测得的反 | |
大小相同的金属片 | 酸溶液 | ||
1 | 镁条 | 1 mol·L-1盐酸 | v1 |
2 | 铁片 | 1 mol·L-1盐酸 | v2 |
3 | 铁片 | 0.1 mol·L-1盐酸 | v3 |
下列结论正确的是
A.v1>v2>v3B.v3>v2>v1C.v1>v3>v2D.v2>v3>v1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关溶液配制说法错误的是( )
A. 称取12.5g胆矾(CuSO4·5H2O)溶于水中,并加水稀释至500mL,所得溶液物质的量浓度为0.1mol·L-1
B. 取58.5 g NaCl固体放入1 L水中充分溶解,所得溶液中NaCl的物质的量浓度为1 mol·L-1
C. 将100g5%的食盐水加热蒸发掉50g水后,所得溶液中NaCl的质量分数为10%
D. 将浓度为2 mol·L-1硫酸钠溶液10 mL加水稀释至200 mL,所得溶液浓度为0.1mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在25mL0.1mol/LNaOH 溶液中逐滴加入0.2mol/LCH3COOH 溶液,下图曲线所示的有关粒子浓度关系错误的是
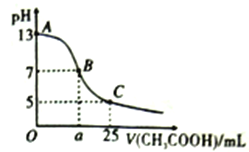
A. 任一点一定都有c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
B. B点:a=12.5,c(Na+ ) =c(CH3COO-)>c(OH-)= c(H+)
C. C点:c(CH3COO-)+ c(CH3COOH)=2 c(Na+ )=0.1mol/L
D. C点:c(CH3COO-):c(CH3COOH))=3:2,则CH3COOH的Ka=1.5×10-5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com