
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء�E��ͬ����Ԫ�ؽ�������ǿ��Ԫ�ء��ס��ҡ�����������������������Ԫ���е����ֻ�����ɵĻ�������ǵ�ת����ϵ��ͼ��ʾ�����м��������еĵ�ζƷ�����ǵ���ɫ���塣����˵������ȷ����
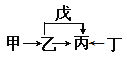
A. ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��r(E)>r(F)>r(C)>r(D)
B. Ԫ��F���������ˮ�ﻯ������һ������������ǿ
C. Ԫ��B���⻯����ܾ�����������ṹ
D. ������A4BC2D�ȿ����ǹ��ۻ����Ҳ�������ӻ�����
���𰸡�B
��������A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء�E��ͬ����Ԫ�ؽ�������ǿ��Ԫ�أ���EΪ��Ԫ�أ���������ͼ�Ƶ����Ҽ��������еĵ�ζƷ�����ǵ���ɫ���壬��֪��Ϊ�Ȼ��ƣ���Ϊ�������ƣ����Ϊ̼���ƣ���Ϊ�������ƣ����Ƕ�����̼����A��B��C��D��E��F�ֱ�ΪH��C��N��O��Na��Cl��A. ͬ������Ԫ�ش�����ԭ�Ӱ뾶��С��ͬ����Ԫ�ش��϶���ԭ�Ӱ뾶������ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��r(Na)>r(Cl)>r(N)>r(O)��ѡ��A��ȷ��B. Ԫ��Cl������������ˮ�ﻯ������һ������������ǿ������������������ˮ�������ܱȽ�������HClO�����ᣬѡ��B����ȷ��C. Ԫ��B���⻯��CH4������������ṹ��ѡ��C��ȷ��D. ������A4BC2D�ȿ����ǹ��ۻ�����CO(NH2)2��Ҳ�������ӻ�����NH4CNO��ѡ��D��ȷ����ѡB��
�����͡���ѡ��
��������
6
����Ŀ����ͼ��ʾװ�ÿɼ��������ҵ��ˮ�к������ӣ�NH4+��������˵������ȷ����

A. ���ǵ���ת��Ϊ��ѧ�ܵ�װ��
B. ������������ʱ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. ������H2��N2�����ʵ���֮��Ϊ3:1���������ˮ��pH��С
D. ��ع���ʱ���׳��е�Na������Mg�缫
���𰸡�D
��������A�����л��ý���þ��ԭ��صĸ�����ʯīΪ�����γ�ԭ��أ���������ԭ��صĵ��أ�������Թ�ҵ��ˮ�������ǽ�����ת��Ϊ��ѧ�ܵ�װ�ã�ѡ��A��ȷ��B�����������º�����������ʱת��Ϊ��������Ӧ�����ӷ���ʽΪ��3Cl2 + 2NH4+=N2 + 6Cl-+8H+��ѡ��B��ȷ��C��������H2��N2�����ʵ���֮��Ϊ3:1�����ݵ缫��Ӧ6H++6e-=3H2����3Cl2 + 2NH4+=N2 + 6Cl-+8H+���������ˮ��H+Ũ������pH��С��ѡ��C��ȷ��D����ع���ʱ���׳���ԭ��أ�ԭ�����������Na����������ʯī�缫��ѡ��D����ȷ����ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Na2SO3����������ɷ�����Ӧ��Na2SO3+ H2SO4=Na2SO4+H2O+SO2������ͼ��ʵ������ȡSO2����֤SO2��ijЩ���ʵ�װ��ͼ���ش���ȷ������ ��

A. ���е�ʵ������Ϊ��ɫʯ����Һ��ɫ��ʵ��֤��SO2����Ư����
B. ������Һ���������ΪSO2��H2S������������ԭ��Ӧ����������ͻ�ԭ����������Ϊ1��1
C. ����������Һ����ɫ������ɫ��ԭ����ͬ
D. ʵ�����п����ó���ʯ��ˮ��������������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ǹ�ˮ����[Cr(CH3COO)2]2��2H2O��һ���������ռ���Ϊ����ɫ���壬�ױ������������Ҵ���������ˮ������(�ӷ����л��ܼ�)�����Ʊ�װ�ü��������£�
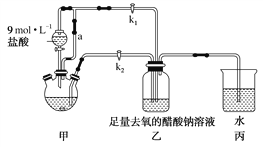
�ټ��װ�������ԣ���������ƿ�����μ������п�ۡ�����CrCl3��Һ��
�ڹر�k2��k1��������Һ©�������������ƺõ��١�
�۴�������ƿ�ڵ���Һ������ɫ(Cr3��)��Ϊ����ɫ(Cr2��)ʱ������Һת�Ƶ�װ�����У������ִ�������ɫ����ʱ���رշ�Һ©����������
�ܽ�װ�����л������ٹ��ˡ�ϴ�Ӻ�������õ�2.76 g[Cr(CH3COO)2]2��2H2O��
(1)װ�ü�����ͨ��a��������______________________��
(2)������ƿ�е�Zn��������������H2�⣬��������һ����Ӧ�����ӷ���ʽΪ______________________��
(3)ʵ�鲽�������Һ�Զ�ת����װ�����е�ʵ�����Ϊ______________________��
(4)װ�ñ��е��ܿ�ˮ���Ŀ����______________________��
(5)ϴ�Ӳ�Ʒʱ��Ϊ��ȥ�����������ʺ�ˮ�֣������Լ�����ȷʹ��˳����________(����ĸ)��
a�����ѡ�b��ȥ���������ˮ��c����ˮ�Ҵ�
(6)��ʵ����ȡ�õ�CrCl3��Һ�к�����3.17 g����[Cr(CH3COO)2]2��2H2O(��Է�������Ϊ376)�IJ�����______________________��
(7)һ�������£�[Cr(CH3COO)2]2��2H2O���ȵõ�CO��CO2�Ļ�����壬�����ʵ���������������Ĵ���________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б仯���л�ѧ���Ķ��ѵ���
A.HCl����ˮB.�ƾ��Ļӷ�C.�ɱ�������D.�ü�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼ��װ�ý���ʵ���ܳɹ������Ӧʵ�����
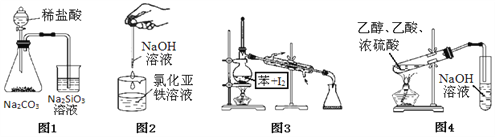
A. ͼ1:֤���ǽ�����ǿ����C��Si B. ͼ2:�Ʊ�����������
C. ͼ3:����Ⲣ���ձ� D. ͼ4:��ȡ���ռ���������
���𰸡�C
��������A��ϡ�������лӷ��ԣ���Ӧ�����Ķ�����̼�к����Ȼ�������ʹ�����Ʒ�Ӧ���ɹ�������IJ�һ����̼�ᣬ����֤���ǽ�����C��Si��ѡ��A����B��Ϊ��ֹ�Ƶõĵ����������������������뽫�ιܲ嵽Һ�����»���Һ���ϼӱ������Է�ֹ����������������Һ��������������������ѡ��B����C�������ڱ��У����÷е�IJ�ͬ����ʹ��������������ձ���ʵ��װ�ü�������ȷ��ѡ��C��ȷ��D����ȡ���ռ���������ʱ�����ñ���̼������Һ������������������������������Һ��ѡ��D����ѡC��
�����͡���ѡ��
��������
5
����Ŀ��A��B��C��D��E��F��ԭ��������������Ķ���������Ԫ�ء�E��ͬ����Ԫ�ؽ�������ǿ��Ԫ�ء��ס��ҡ�����������������������Ԫ���е����ֻ�����ɵĻ�������ǵ�ת����ϵ��ͼ��ʾ�����м��������еĵ�ζƷ�����ǵ���ɫ���塣����˵������ȷ����
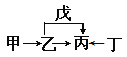
A. ԭ�Ӱ뾶�ɴ�С��˳��Ϊ��r(E)>r(F)>r(C)>r(D)
B. Ԫ��F���������ˮ�ﻯ������һ������������ǿ
C. Ԫ��B���⻯����ܾ�����������ṹ
D. ������A4BC2D�ȿ����ǹ��ۻ����Ҳ�������ӻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʱ���ڡ����ݸ�Ŀ����д�����վƷǹŷ�Ҳ����Ԫʱʼ���䷨����Ũ�ƾ�������굣��������ϣ�������ȡ��¶���������漰�IJ���������
A.��ҺB.��ȡC.����D.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ��һ���������ȷ�Ӧ���ǣ�������
A.����Ȼ��ȼ���������ķ�Ӧ
B.������ԭ��Ӧ
C.��������������Ȼ�茶����Ͻ���
D.һ����̼��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʹ��֮ǰ��Ҫ����Ƿ�©Һ���ǣ�������
�ٷ�Һ©�� �ڳ���©�� ������ƿ ��������ƿ ��ϴ��ƿ��
A. �٢ڢ� B. �٢� C. �٢ۢ� D. �٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij��̬����A���仯����֮���ת����ϵ��ijЩ����ͷ�Ӧ��������ȥ����������B�ڳ��³�ѹ��Ϊ���壬B��C����Է�������֮��Ϊ4��5��������D����Ҫ�Ĺ�ҵԭ�ϣ� 
��1��д��A�ڼ�����������H2��Ӧ�Ļ�ѧ����ʽ
��2��д��E��A���⻯�ﷴӦ����A�Ļ�ѧ����ʽ
��3��д��һ����D����B�Ļ�ѧ����ʽ��
��4����5mL0.10molL��1��E��Һ��10mL0.10molL��1��NaOH��Һ��ϣ� ��д����Ӧ�����ӷ���ʽ��
�ڷ�Ӧ����Һ��pH7������ڡ�����С�ڡ����ڡ�������������
�ۼ��ȷ�Ӧ�����Һ����pH������������䡱��С������������ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com