

 £©µÄ·ĻĖ®æÉŅŌĄūÓĆĪ¢ÉśĪļµē³Ų³żČ„£¬ĘäŌĄķČēĶ¼2ĖłŹ¾£®
£©µÄ·ĻĖ®æÉŅŌĄūÓĆĪ¢ÉśĪļµē³Ų³żČ„£¬ĘäŌĄķČēĶ¼2ĖłŹ¾£® +2e-+H+ØT
+2e-+H+ØT +Cl-£®
+Cl-£®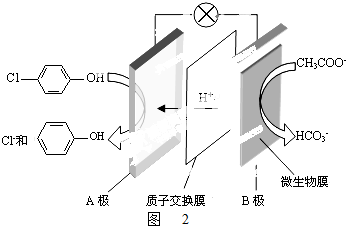
·ÖĪö ÅšĆ¾æóÖ÷ŅŖ³É·ÖĪŖMg2B2O5•H2O£¬ÅšÉ°µÄ»ÆѧŹ½ĪŖNa2B4O7•10H2O£®ĄūÓĆÅšĆ¾æóÖĘČ”½šŹōĆ¾¼°“ÖÅšµÄ¹¤ŅÕĮ÷³ĢÖŠÅšĆ¾æó¼ÓČėĒāŃõ»ÆÄĘÅØČÜŅŗ¹żĀĖµĆµ½ĀČ»ÆĆ¾£¬¼ÓČėÅØŃĪĖįČܽāĶعżÕō·¢ÅØĖõµĆµ½ĀČ»ÆĆ¾½į¾§Ė®ŗĻĪļ£¬ŌŚĀČ»ÆĒāĘųĮ÷ÖŠ¼ÓČȵƵ½ĀČ»ÆĆ¾¹ĢĢ壬µē½āµĆµ½Ć¾£»ĀĖŅŗÖŠÖ÷ŅŖŹĒNaBO2£¬ĶØČėŹŹĮ涞Ńõ»ÆĢ¼ĘųĢåµĆµ½ÅšÉ°£¬ČÜÓŚČČŗó£¬ÓĆH2SO4µ÷pH2”«3ÖĘČ”H3BO3£¬¼ÓČȵƵ½B2O3£»
£Ø1£©ÅšÉ°µÄ»ÆѧŹ½ĪŖNa2B4O7•10H2O£¬ŅĄ¾ŻŌŖĖŲ»ÆŗĻ¼Ū±ź×¢¼ĘĖćÅšŌŖĖŲ»ÆŗĻ¼Ū£»ÓĆH2SO4µ÷pH2”«3£¬ÅšÉ°ÖŠµÄNa2B4O7ŌŚĖįČÜŅŗÖŠÉś³ÉH3BO3 £»XĪŖH3BO3¾§Ģå¼ÓČČĶŃĖ®µÄ²śĪļµĆµ½B2O3£¬Ć¾ŗĶµĆµ½B2O3·“Ӧɜ³ÉŃõ»ÆĆ¾ŗĶÅš£»
£Ø2£©ĀČ»ÆĆ¾ŌŚĖ®ČÜŅŗÖŠĖ®½āÉś³ÉĒāŃõ»ÆĆ¾£»
£Ø3£©Č¼ĮĻµē³ŲÖŠÕż¼«ÉĻŹĒ¹żŃõ»ÆĒāµĆµ½µē×ÓÉś³ÉĖ®£»PH=6¼ĘĖćĒāŃõøłĄė×ÓÅØ¶Č£¬½įŗĻÉś³ÉĆ¾Ąė×ÓÅØ¶Č¼ĘĖćÅضČÉĢŗĶČܶȻż³£Źż±Č½Ļ·ÖĪöŹĒ·ńÉś³ÉĒāŃõ»ÆĆ¾³Įµķ£»
£Ø4£©H2S2O3ĪŖČõĖį£¬Na2S2O3ČÜŅŗĻŌ¼īŠŌ£¬¾Ż“ĖŃ”ŌńµĪ¶Ø¹Ü£»øł¾Ż¹ŲĻµŹ½B”«BI3”«$\frac{3}{2}$I2”«3S2O32-¼°µĪ¶ØŹż¾Ż¼ĘĖć³ö“ÖÅšÖŠÅšµÄŗ¬Į棻
£Ø5£©¢Łøł¾ŻŌµē³ŲÖŠŃōĄė×ÓµÄŅĘ¶Æ·½ĻņČ·¶ØÕżøŗ¼«£»
¢Śøł¾ŻÕż¼«ÉĻ·¢ÉśµĆµē×ӵĻ¹Ō·“Ó¦Ą“ŹéŠ“£®
½ā“š ½ā£ŗ£Ø1£©ÅšÉ°µÄ»ÆѧŹ½ĪŖNa2B4O7•10H2O£¬ÄĘŌŖĖŲ»ÆŗĻ¼ŪĪŖ+1¼Ū£¬ŃõŌŖĖŲ»ÆŗĻ¼Ū-2¼Ū£¬ŅĄ¾Ż»ÆŗĻ¼Ū“śŹżŗĶ¼ĘĖćµĆµ½ÅšŌŖĖŲ»ÆŗĻ¼ŪĪŖ+3¼Ū£»ÓĆH2SO4µ÷pH2”«3£¬ÅšÉ°ÖŠµÄNa2B4O7ŌŚĖįČÜŅŗÖŠÉś³ÉH3BO3 £¬·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗB4O72-+2H++5H2O=4H3BO3£¬XĪŖH3BO3¾§Ģå¼ÓČČĶŃĖ®µÄ²śĪļŹĒB2O3£¬Ć¾ŗĶµĆµ½B2O3·“Ӧɜ³ÉŃõ»ÆĆ¾ŗĶÅš£¬·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ3Mg+B2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$2B+3MgO£¬·“Ó¦ÖŠŌŖĖŲ»ÆŗĻ¼Ū½µµĶµÄ×öŃõ»Æ¼Į£¬ÅšŌŖĖŲ»ÆŗĻ¼Ū+3¼Ū±ä»ÆĪŖ0¼Ū£¬ŌņB2O3×öŃõ»Æ¼Į£»
¹Ź“š°øĪŖ£ŗ+3£»B4O72-+2H++5H2O=4H3BO3£»3Mg+B2O3$\frac{\underline{\;øßĪĀ\;}}{\;}$2B+3MgO£»
£Ø2£©MgCl2•7H2OŠčŅŖŌŚHCl·ÕĪ§ÖŠ¼ÓČČ£¬ŹĒĪŖĮĖ·ĄÖ¹ĀČ»ÆĆ¾Ė®½āÉś³ÉĒāŃõ»ÆĆ¾£¬
¹Ź“š°øĪŖ£ŗ·ĄÖ¹MgCl2Ė®½āÉś³ÉMg£ØOH£©2£»
£Ø3£©Ć¾-H2O2ĖįŠŌČ¼ĮĻµē³ŲµÄ·“Ó¦»śĄķĪŖMg+H2O2+2H+ØTMg2++2H2O£¬Õż¼«ÉĻŹĒ¹żŃõ»ÆĒāµĆµ½µē×ÓÉś³ÉĖ®µÄ·“Ó¦£¬Õż¼«·“Ó¦Ź½H2O2+2H++2e-=2H2O£»Ksp[Mg£ØOH£©2]=5.6”Į10-12£¬µ±ČÜŅŗpH=6Ź±£¬c£ØOH-£©=10-8mol/L£¬ŌņQc=c£ØMg2+£©”Įc2£ØOH-£©=0.045mol/L”Į10-16mol/L=4.5”Į10-18£¼Ksp[Mg£ØOH£©2]£¬ĖµĆ÷ĪŽĒāŃõ»ÆĆ¾³ĮµķÉś³É£»
¹Ź“š°øĪŖ£ŗH2O2+2H++2e-=2H2O£»ĪŽ£»
£Ø4£©H2S2O3ĪŖČõĖį£¬Na2S2O3ČÜŅŗĻŌ¼īŠŌ£¬¾Ż“ĖŃ”ŌńµĪ¶Ø¹ÜÓ¦ĪŖ¼ņŹ½µĪ¶Ø¹Ü£»
Įņ“śĮņĖįÄʵÄĪļÖŹµÄĮæĪŖ£ŗ0.30mol/L”Į0.018L=0.0054mol£¬I2+2S2O32-=2I-+S4O62-£¬
øł¾Ż¹ŲĻµŹ½£ŗB”«BI3”«$\frac{3}{2}$I2”«3S2O32-£¬
n£ØB£©=$\frac{1}{3}$n£ØS2O32-£©=0.0018mol£¬
ÅšµÄÖŹĮæĪŖ£ŗ10.81g/mol”Į0.0018mol=0.01944g£¬“ÖÅšÖŠÅšµÄŗ¬ĮæĪŖ£ŗ$\frac{0.01944g}{0.0200g}$”Į100%=97.2%£¬
¹Ź“š°øĪŖ£ŗ¼īŹ½£»97.2£»
£Ø5£©¢ŁŌµē³ŲÖŠĒāĄė×ÓµÄŅĘ¶Æ·½ĻņŹĒ“Óøŗ¼«Į÷ĻņÕż¼«£¬ĖłŅŌBŹĒµē³ŲµÄøŗ¼«£¬
¹Ź“š°øĪŖ£ŗøŗ£»
¢ŚAŹĒÕż¼«£¬Õż¼«ÉĻ·¢ÉśµĆµē×ӵĻ¹Ō·“Ó¦£ŗ +2e-+H+ØT
+2e-+H+ØT +Cl-£¬
+Cl-£¬
¹Ź“š°øĪŖ£ŗ +2e-+H+ØT
+2e-+H+ØT +Cl-£®
+Cl-£®
µćĘĄ ±¾Ģāæ¼²éĮĖŃĪĄąµÄĖ®½ā”¢Ōµē³ŲŌĄķŗĶµē½ā³ŲŌĄķµÄ·ÖĪö£¬³ĮµķČܽāĘ½ŗāµÄ¼ĘĖćÓ¦ÓĆ£¬ĢāÄæÄѶČÉŌ“󣬼ĘĖćŹĒÄŃµć£¬¼ĘĖ揱ŅŖ³ä·ÖĄūÓĆĢāÄæĖłøųŹżĮæ¹ŲĻµŗĶ±ķÖŠŹż¾Ż£¬øł¾ŻÖŹĮæ¹ŲĻµŗĶÖŹĮæ·ÖŹżµÄøÅÄīæģĖŁ½āĢā£®


 ³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
³¬ÄÜѧµäÓ¦ÓĆĢāĢāæØĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

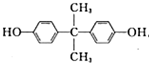 £¬GŹĒŅ»ÖÖøß·Ö×Ó£¬æÉÓĆÓŚÖĘŌģŅžŠĪŃŪ¾µµÄ²ÄĮĻ£®HĪŖĮłŌŖ»·õ„£®
£¬GŹĒŅ»ÖÖøß·Ö×Ó£¬æÉÓĆÓŚÖĘŌģŅžŠĪŃŪ¾µµÄ²ÄĮĻ£®HĪŖĮłŌŖ»·õ„£® £®
£® £®
£® £®
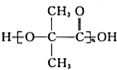
£®
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
×å ÖÜĘŚ | ¢ńA | ¢ņA | ¢óA | ¢ōA | ¢õA | ¢öA | ¢÷A | 0 |
| ¶ž | ¢Ł | ¢Ś | ||||||
| Čż | ¢Ū | ¢Ü | ¢Ż | ¢Ž | ¢ß | ¢ą | ||
| ĖÄ | ¢į | ¢ā |

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | 90 | B£® | 27 | C£® | 10.8 | D£® | 9 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
 ŅŃÖŖ£ŗ¢ŁĪŽĖ®ĀČ»ÆøĘæÉÓėŅŅ“¼ŠĪ³ÉÄŃČÜÓŚĖ®µÄCaCl2•6C2H5OH£®
ŅŃÖŖ£ŗ¢ŁĪŽĖ®ĀČ»ÆøĘæÉÓėŅŅ“¼ŠĪ³ÉÄŃČÜÓŚĖ®µÄCaCl2•6C2H5OH£®| ŹŌ¼Į | ŅŅĆŃ | ŅŅ“¼ | ŅŅĖį | ŅŅĖįŅŅõ„ |
| ·Šµć/”ę | 34.7 | 78.5 | 118 | 77.1 |
 CH3COOCH2CH3+H218O£®
CH3COOCH2CH3+H218O£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
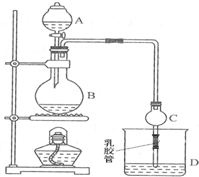
 ÓĆMnO2ŗĶÅØŃĪĖįÖĘČ”“æ¾»øÉŌļµÄĀČĘų£¬²¢ČĆĀČĘųÓėĶ·Ū·“Ó¦ÖĘČ”“æ¾»µÄĪŽĖ®CuCl2£¬×°ÖĆČēĶ¼ĖłŹ¾£®
ÓĆMnO2ŗĶÅØŃĪĖįÖĘČ”“æ¾»øÉŌļµÄĀČĘų£¬²¢ČĆĀČĘųÓėĶ·Ū·“Ó¦ÖĘČ”“æ¾»µÄĪŽĖ®CuCl2£¬×°ÖĆČēĶ¼ĖłŹ¾£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹¤ŅµÉĻ³£ÓƵē½āČŪČŚDµÄŃõ»ÆĪļĄ“ÖʱøDµÄµ„ÖŹ | |
| B£® | µ„ÖŹC”¢D×Å»š£¬Ćš»šŹ±C²»ÄÜÓĆÅŻÄĆš»šĘ÷£¬µ«DæÉŅŌÓĆÅŻÄĆš»šĘ÷Ćš»š | |
| C£® | »ÆŗĻĪļA2B2ÓėC2B2Ėłŗ¬»Æѧ¼üĄąŠĶĶźČ«ĻąĶ¬ | |
| D£® | A”¢B”¢C×é³ÉµÄ»ÆŗĻĪļ£¬ČōČÜŅŗÅضČĪŖ0.01mol/L£¬Ōņ³£ĪĀĻĀĘäPHĪŖ12 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £»
£» £»
£»²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
| ±ąŗÅ | ²Ł×÷ | ĻÖĻó |
| I | ĻČĻņ2mL 0.1mol/L FeCl2ČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ£¬ŌŁµĪ¼ÓŠĀÖĘĀČĖ® | |
| II | ĻČĻņ2mL 0.1mol/L FeCl3ČÜŅŗÖŠµĪ¼ÓKSCNČÜŅŗ£¬ŌŁµĪ¼Ó0.1mol/L KIČÜŅŗ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com