
| A. | KOH | B. | Na2SO4 | C. | CO2 | D. | HCl |
科目:高中化学 来源: 题型:选择题
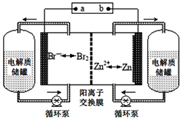 锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )
锌溴液流电池是一种新型电化学储能装置(如图所示),电解液为溴化锌水溶液,电解质溶液在电解质溶液在电解质储罐和电池间不断循环.下列说法不正确的是( )| A. | 阳离子交换膜可阻止Br2与Zn直接发生反应 | |
| B. | 放电时正极的电极反应式为Br2+2e-═2Br- | |
| C. | 充电时电极b连接电源的正极 | |
| D. | 放电时左侧电解质储罐中的离子总浓度增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 碳及其化合物有广泛的用途.
碳及其化合物有广泛的用途.| 温度/℃ | 起始浓度mol/L | 平衡浓度mol/L | |
| CO(g) | H2O(g) | H2(g) | |
| 900 | 2.0 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 mol | B. | 1.5 mol | C. | 1.8 mol | D. | 2.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2是红棕色气体,易溶于水,不是酸性氧化物 | |
| B. | NO可以用排水法收集,但不能由N2和O2直接化合而得到 | |
| C. | NO、NO2在一定条件下可相互转化,且二者都是引起光化学烟雾的大气污染物 | |
| D. | NO、NO2都有毒,且NO是汽车尾气的有害成分之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯和氢气制环己烷;苯的硝化反应;属于同一反应类型 | |
| B. | 乙烷和氯气制氯乙烷;乙烯与氯化氢反应制氯乙烷属于同一反应类型 | |
| C. | 乙烷和丙烯混合物的物质的量为1mol,完全燃烧生成3molH2O | |
| D. | 一定条件下,乙醇可发生消去反应,甲醇也可发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
物质 n/mol T/℃ | 活性炭 | NO | E | F |
| 初始 | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③⑤ | C. | ②③ | D. | ②④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com