
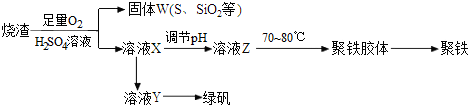

分析 制备聚铁和绿矾(FeSO4•7H2O)流程为:硫酸厂烧渣与硫酸、氧气反应,得到滤液X和不溶物(S、二氧化硅等)W;滤液X中进入铁粉生成硫酸亚铁溶液,硫酸亚铁溶液通过浓缩蒸发、冷却结晶得到绿矾;将滤液X通过调节pH获得溶液Z,在70~80℃条件下得到聚铁聚铁,最后得到聚铁,
(1)此题为二氧化硫的验证,利用其特殊性质漂白性来分析;
(2)根据实验目的连接仪器;A中铜和浓硫酸加热反应生成硫酸铜、二氧化硫和水;
(3)利用二价铁与三价铁之间的相互转化来分析器;
(4)依据高锰酸钾溶液具有强氧化性分析滴定管使用;
(5)根据聚铁的化学式中铁与氢氧根离子的关系判断.
解答 解:制备聚铁和绿矾(FeSO4•7H2O)流程为:硫酸厂烧渣与硫酸、氧气反应,得到滤液X和不溶物(S、二氧化硅等)W;滤液X中进入铁粉生成硫酸亚铁溶液,硫酸亚铁溶液通过浓缩蒸发、冷却结晶得到绿矾;将滤液X通过调节pH获得溶液Z,在70~80℃条件下得到聚铁聚铁,最后得到聚铁,
(1)检验二氧化硫的一般方法是:将气体通入品红溶液中,如果品红褪色,加热后又恢复红色,证明有二氧化硫,
故答案为:将气体通入品红溶液,溶液褪色,加热恢复原色;
(2)收集二氧化硫应先干燥再收集,二氧化硫的密度比空气大,要从c口进气,最后进行尾气处理,所以按气流方向连接顺序为a→d→e→c→b→f;
装置A中铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O,
故答案为:d;e;c;b;Cu+2H2SO4(浓)═CuSO4+SO2↑+2H2O;
(3)因为在烧渣中加入了硫酸和足量氧气,故溶液Y中含有Fe3+,所以应先加入过量的铁粉,
故答案为:铁屑;
(4)KMnO4标准溶液具有强氧化性,腐蚀橡胶管,滴定时需要选择酸式滴定管,
故答案为:酸式;
(5)聚铁的化学式为Fe2(OH)n(SO4)3-0.5n,若溶液Z的pH偏小,则聚铁中生成的氢氧根的含量减少,据此计算的铁的含量减少,铁的质量分数偏小,
故答案为:偏小.
点评 本题考查了化学物质的制备方案的设计,题目难度中等,明确制备原理及化学实验操作方法为解答关键,对学生来说高铁不是很熟悉,但是铁与亚铁之间的转化还是很容易实现的,起点高,落点低,是一道质量较好的题目,试题充分培养了学生的分析、理解能力及化学实验能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
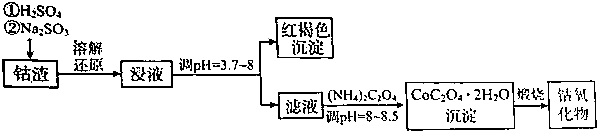
| 温度范围(℃) | 残留固体质量(g) |
| 150~210 | 4.41 |
| 290~320 | 2.41 |
| 890~920 | 2.25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 有关信息 |
| A | 最高价氧化物对应的水化物与其氢化物反应生成离子化合物 |
| B | 地壳中含量最多的元素 |
| C | 单质须保存在煤油中 |
| D | 单质与NaOH溶液反应可用于生产漂白液 |
| E | 单质是生活中用量最大的金属,其制品在潮湿空气中易被腐蚀或损坏 |
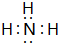 ,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+.
,其最高价氧化物对应的水化物与其氢化物反应的离子方程式:NH3+H+=NH4+. 查看答案和解析>>
科目:高中化学 来源: 题型:填空题
元素 性质 | 8O | 16S | 34Se | 52Te |
| 单质熔点/℃ | -218,4 | 113 | ? | 450 |
| 单质沸点/℃ | -183 | 444.6 | 685 | 989 |
| 主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
| 原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
| 单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴定终点读数时俯视读数 | |
| B. | 锥形瓶洗净后未干燥 | |
| C. | 碱式滴定管滴定前尖嘴部分有气泡,滴定后气泡消失 | |
| D. | 酸式滴定管使用前,水洗后未用待测盐酸润洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中只含有离子键 | B. | HCl分子中含有离子键 | ||
| C. | 12C、13C、14C是碳的三种核素 | D. | 16O、17O、18O含有相同的中子数 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com