
| A、用NaOH溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 |
| B、用丁达尔效应鉴别碳酸溶液和硅酸溶胶 |
| C、用焰色反应鉴别KCl和KNO3 |
| D、用澄清石灰水鉴别SO2和CO2 |


科目:高中化学 来源: 题型:
 (Ⅰ) 在一个容积固定不变的密闭容器中进行反应:
(Ⅰ) 在一个容积固定不变的密闭容器中进行反应:| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol?L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:
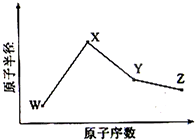 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.下列表述中不正确的是( )| A、X位于元素周期表中第三周期第IA 族 |
| B、W的基态原子核外有2个未成对电子 |
| C、X的单质和Y的单质相比,熔点较高的是X |
| D、Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+3H2O=H2SiO3↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、C2H4和C2H2 |
| B、C2H4和C3H4 |
| C、C3H4和C2H2 |
| D、C3H6和C3H4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②③ |
| C、②③④ | D、全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、阳极发生的电极反应为:Cu2++2e-=Cu |
| B、阴极发生的电极反应为:4OH-=2H2O+O2↑+4e- |
| C、若有6.4g金属Cu析出,放出的O2一定为0.05 mol |
| D、电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
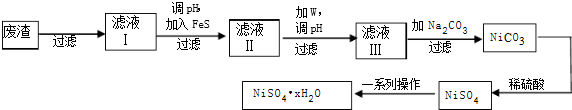
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com