
分析 I.Fe不易溶于水中,应该用酸溶解样品,亚铁离子具有还原性,用强氧化性物质检验亚铁离子且必须有明显现象;
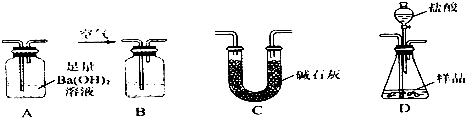
Ⅱ.(1)盛放盐酸的仪器为分液漏斗;先分析实验方案,利用装置B除去空气中的二氧化碳,然后用空气将装置D产生的二氧化碳完全赶到装置A中,为了避免空气中水和二氧化碳干扰,装置A需要连接吸收二氧化碳和水的装置,据此对装置进行排序;
(2)根据通入空气还可以将碳酸钙与盐酸反应生成的二氧化碳驱赶到装置B中分析;
(3)空气中含有二氧化碳,会影响实验测定,需要用氢氧化钠溶液吸收;
(4)由于反应生成的二氧化碳中含有杂质氯化氢和水,导致测定的装置A的质量差增大,测定碳酸钙质量偏大,氧化铁的质量分数偏低
解答 解:I.要检验FeO,应该先将FeO转化为亚铁离子,亚铁离子具有还原性,酸性高锰酸钾溶液能氧化亚铁离子而褪色,高锰酸钾溶液具有强氧化性,能氧化盐酸,所以不能用盐酸酸化高锰酸钾,其检验方法为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO,
故答案为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO;
Ⅱ.(1)根据图示可知,盛放盐酸的装置为分液漏斗;测定样品中Fe2O3的质量分数,先根据CaCO3产生的CO2的质量计算出m(CaCO3),再根据样品质量计算出Fe2O3的质量分数,仪器连接顺序为:先将空气通入盛有NaOH溶液的装置B,以便除去空气中的CO2碳,然后利用空气将装置D中产生的CO2驱赶到装置A,利用CO2与Ba(OH)2生成的BaCO3沉淀的质量计算出m(CaCO3),由于空气中的CO2、水蒸气影响测定结果,需要在装置A后连接一个吸收CO2、水蒸气的装置C,所以装置连接顺序为:BDAC,
故答案为:分液漏斗;B;D;A;C;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的CO2尽可能彻底的赶入装置A中,使反应生成的CO2能够被Ba(OH)2溶液完全吸收,
故答案为:将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收;
(3)空气中含有CO2,会影响实验测定,而装置B中应该盛放NaOH溶液,从而吸收空气中的CO2,避免空气中的CO2影响测定结果,故d正确,
故答案为:d;
(4)由于装置D生成的CO2中混有HCl和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的CO2的质量偏大,m(CaCO3)会偏大,样品中m(Fe2O3)偏小,Fe2O3的质量分数会偏小,
故答案为:偏小.
点评 本题考查物质检验和鉴别的实验方案设计,为高频考点,涉及离子检验、实验装置排序、实验设计等,明确物质性质是解本题关键,注意:高锰酸钾溶液能氧化浓盐酸,所以酸性高锰酸钾溶液中不能滴加浓盐酸,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
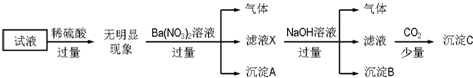
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com