
(1)若反应后铁有剩余,则容器中不可能有_______________,一定有______________。
(2)若反应后有Cu2+和Cu,则不可能有_________。
(3)若反应后有Cu2+和Fe3+,则可能有__________。
解析:将铁粉、铜粉与FeCl3、FeCl2、CuCl2的混合液混合,可发生如下反应:
2Fe3++Fe====3Fe2+
2Fe3++Cu====2Fe2++Cu2+
Cu2++Fe====Fe2++Cu
在上述反应中,同一反应的两种反应物不能同时大量存在。
(1)若反应后铁有剩余,容器中不可能有Fe3+和Cu2+,一定有Fe2+,肯定有Cu。
(2)若反应后有Cu2+和Cu,则不可能有Fe3+和Fe。因为有Cu2+则不可能有Fe,有Cu则不可能Fe3+。
(3)若反应后有Cu2+和Fe3+,则不可能有Fe和Cu,可能有Fe2+。
答案:(1)Fe3+和Cu2+ Fe2+、Cu (2)Fe3+ (3)Fe2+


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
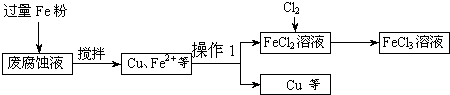
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
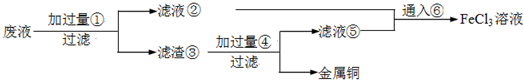
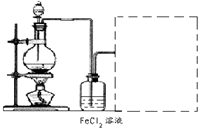
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、两种 | B、三种 | C、四种 | D、五种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com