
【题目】能正确表示四种基本反应类型与氧化还原反应关系的示意图是
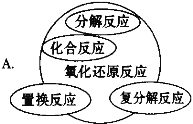
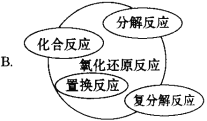
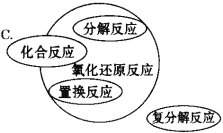
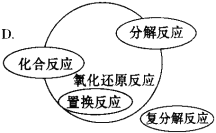
【答案】D
【解析】
试题分析:A、复分解反应一定不属于氧化还原反应,则不会出现交叉,置换反应一定属于氧化还原反应,则应为包含,部分的化合与分解反应属于氧化还原反应,则不能是包含,应为交叉关系,故A错误;B、复分解反应一定不属于氧化还原反应,则不会出现交叉,故B错误;C、有单质生成的分解反应属于氧化还原反应,则分解反应与氧化还原反应的关系为交叉,不是全包含,故C错误;D、置换反应一定属于氧化还原反应,则是包含关系,复分解反应一定不属于氧化还原反应,则不是包含也不是交叉关系,有单质生成的分解反应属于氧化还原反应,有单质参加的化合反应属于氧化还原反应,则化合、分解反应与氧化还原反应都是交叉关系,故D正确;故选D。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】下列各组元素中,在生物体内含量极少,但对维持生物体正常活动必不可少的一组是( )
A. Fe、Mn、Zn、Mg B. Zn、Cu、Mg、Ca
C. Zn、Cu、B、Mn D. S、Mn、Cu、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融盐燃料电池具有高的发电效率,因而受到重视。某燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以丁烷为燃料,以空气为氧化剂,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池负极电极反应式为:2C4H10+26CO32--52e- =34CO2+10H2O。
试回答下列问题:

(1)该燃料电池的化学反应方程式为 ;
(2)正极电极反应式为 。
(3)为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此,必须在通入的空气中加入一种物质,加入的物质是 ,它来自 。
(4)某学生想用该燃料电池和右图所示装置来电解饱和食盐水
①写出反应的离子方程式 。
②将湿润的淀粉KI试纸放在该装置附近,发现试纸变蓝,待一段时间后又发现蓝色褪去,这是因为过量的Cl2将生成的I2氧化。若反应的Cl2和I2的物质的量之比为5:1,且生成两种酸。该反应的化学方程式为 。
③若电解后得到200mL 3.25mol/LNaOH溶液,则消耗C4H10 的体积在标准状况下为 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况。请分析以下一组有现象变化的化学反应。

(1)用离子方程式解释现象I中出现胶状沉淀的原因: 。
(2)II中加碱时出现的现象是 ,此现象说明溶液中发生反应的离子方程式是 。
(3)III中加碱时出现的现象是 。
(4)用离子方程式解释IV中加碱时出现的现象: 。
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验。
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
1.0 mL | 0.1 mol·L1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 mol·L1 H2SO4溶液; 再滴加1.0 mL 0.5 mol·L1 NaOH溶液 | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:向1.0 mL 0.1 mol·L1 Fe(NO3)2溶液中 ,溶液立即变红,说明溶液中含Fe3+,证明加酸时溶液中发生了反应。
② 推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1 mol·L1 Fe(NO3)2溶液中的Fe2+被NO3-氧化;
b. (用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
B.氢氧化钡与硫酸反应:OH-+H+===H2O
C.铜片插入硝酸银溶液中发生反应:Cu+Ag+===Cu2++Ag
D.氯化镁溶液与氢氧化钠溶液发生反应:Mg2++2OH-===Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。比如氢气就是一种高效而没有污染的二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.焦炉煤气是一级能源 D.煤是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生反应,化学方程式如下(已配平):
Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O
CuSO4+A↑+2H2O
试通过计算和推理完成下面的问题:
(1)A物质可以与强碱反应生成盐和水,则A应该属于 (用字母代号填写)。
a.酸 b.碱 c.盐 d.酸性氧化物 e.碱性氧化物
(2)该反应中被还原的元素是 (填元素名称);氧化产物是 (填化学式)。
(3)若反应消耗了3.2g Cu,则转移电子数 ,被还原的硫酸物质的量为 mol。
(4)将(2)中反应后所得到的溶液稀释后与足量BaCl2溶液反应,写出此过程发生反应的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com