
分析 一份向混合溶液中加入过量BaCl2溶液,发生反应SO42-+Ba2+=BaSO4 ↓,充分反应后得沉淀2.33g为BaSO4的质量,根据硫酸钡的质量,利用硫酸根守恒计算计算硫酸的物质的量;另一份混合溶液中加入50mL 1.0 mol•L-1NaOH溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HNO3+NaOH=NaNO3+H2O,充分反应后溶液的pH=13即氢氧根浓度为0.1mol/L(溶液的体积为100mL),则消耗的氢氧根为0.05×1.0-0.1×0.1=0.04mol,根据硫酸的物质的量计算与硫酸反应的氢氧化钠的物质的量,进而计算与硝酸反应的氢氧化钠的物质的量,再根据方程式计算HNO3的物质的量,根据c=$\frac{n}{V}$计算HNO3的物质的量浓度.
解答 解:(1)2.33gBaSO4的物质的量为:$\frac{2.33g}{233g/mol}$=0.01mol,根据硫酸根守恒n(H2SO4)=n(BaSO4)=0.01mol,原溶液中所含的硫酸的物质的量为0.01×2=0.02mol
故答案为:0.02;
(2)另一份混合溶液中加入50mL 1.0 mol•L-1NaOH溶液,发生的反应是H2SO4+2NaOH=Na2SO4 +2H2O,HNO3+NaOH=NaNO3+H2O,充分反应后溶液的pH=13即氢氧根浓度为0.1mol/L(溶液的体积为100mL),则消耗的氢氧根为0.05×1.0-0.1×0.1=0.04mol,根据方程式H2SO4+2NaOH=Na2SO4 +2H2O可知,以0.01mol硫酸反应消耗氢氧化钠的物质的量为0.01mol×2=0.02mol,故与硝酸反应氢氧化钠的物质的量为:0.04mol-0.02mol=0.02mol,
由方程式HNO3+NaOH=NaNO3+H2O可知,n(HNO3)=n(NaOH)=0.02mol,故HNO3的物质的量浓度为:$\frac{0.02mol}{0.05L}$=0.4mol/L,
故答案为:0.4.
点评 本题考查根据方程式的计算,比较基础,清楚反应过程是解题的关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.
酒在酿造过程中部分醇会转化为羧酸,进而形成各种酯类化合物,使酒具有了特殊的香味.国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30g/L,总酯量(以乙酸乙酯计)应不少于2.0g/L.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲苯的分子式为: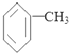 | |
| B. | 甲苯分子中所有原子都处于同一平面 | |
| C. | 甲苯的一氯取代物有5种同分异构体,它们的熔点、沸点各不相同 | |
| D. | 甲苯和苯互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
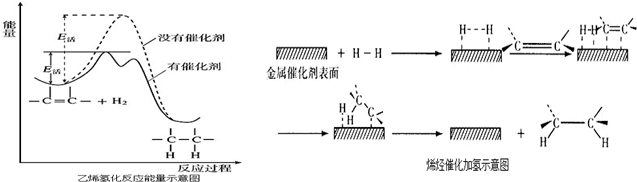
| A. | 乙烯和H2生成乙烷的反应是吸热反应 | |
| B. | 加入催化剂,可减小反应的热效应 | |
| C. | 催化剂能改变平衡转化率,不能改变化学反应的平衡常数 | |
| D. | 催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某试样焰色反应呈黄色,则试样中可能含有K+ | |
| B. | 广泛pH试纸测得某新制氯水的pH为4 | |
| C. | 配制240ml某溶液,应选240ml容量瓶 | |
| D. | 可用排饱和食盐水来收集纯净的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com