
 伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )
伏打电堆是由几组锌和银的圆板堆积而成,所有的圆板之间夹放着几张盐水泡过的布.图为最初的伏打电堆模型,由八组锌和银串联组成的圆板堆积而成.下列说法正确的是( )| A. | 该原电池正极的电极方程式为:O2+4e-+4H+═2H2O | |
| B. | 电池长时间工作后,中间的布上会有白色固体颗粒生成,该固体颗粒为Ag2O | |
| C. | 当电路中转移0.2 mol电子时,消耗锌板的总质量为52 g | |
| D. | 该伏打电堆工作时,在银板附近会有Cl2放出 |
分析 该原电池中,活泼金属锌作负极失电子发生氧化反应,电极反应为:Zn-2e-=Zn2+,银作正极,正极上氧气得电子发生还原反应,电极反应为:O2+4e-+2H2O=4OH-,电池总反应为:2Zn+O2+2H2O=2Zn(OH)2,据此分析解答.
解答 解:A.电解质溶液是食盐水,不是酸性环境,则正极电极反应为:O2+4e-+2H2O=4OH-,故A错误;
B.根据电池总反应2Zn+O2+2H2O=2Zn(OH)2可知电池长时间工作后,中间的布上出现白色固体颗粒应是Zn(OH)2,故B错误;
C.负极反应为Zn-2e-=Zn2+,转移电子0.2mol时,一组锌消耗的质量为0.1mol×65g/mol=6.5g,八组锌消耗的总质量为6.5g×8=52g,故C正确;
D.银作正极,正极上氧气得电子发生还原反应,不会有氯气放出,故D错误;
故选C.
点评 本题考查原电池的工作原理,为高频考点,正确书写电极反应式是解题的关键,易错点是选项C,侧重于学生分析能力和灵活应用能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 化石燃料完全燃烧不会造成大气污染 | |
| B. | CaCl2•6H2O可做袋装食品的干燥剂 | |
| C. | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | |
| D. | 可用Na2CO3治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )
科学家尝试用微生物电池除去废水中的有害的有机物,其原理如图所示.下列有关说法正确的是( )| A. | 若 1mol  转化为 1mol 苯酚转移 2mole-,则同时生成的 X 为氯气 转化为 1mol 苯酚转移 2mole-,则同时生成的 X 为氯气 | |
| B. | 用该电池电解饱和食盐水(使用情性电极的电解槽)毎产生 22.4L 的氢气,B 极上生成 0,.5molHCO3- | |
| C. | A 极为正极,B 极为负极 | |
| D. | 电池工作过程中 A 极周围溶液 pH 不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
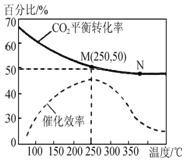 一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )
一定条件下合成乙烯反应:6H2(g)+2CO2(g)?CH2═=CH2(g)+4HO(g),已知温度对CO2的平衡转化率和催化剂催化效率的影响如图所示,下列说法不正确的是( )| A. | 平衡常数:KM>KN | |
| B. | 生成乙烯的速率一定有:v(M)<v(N) | |
| C. | 若投料比n(H2):n(CO2)=3:1,O 达到平衡时,M点乙烯的体积分数约为7.7% | |
| D. | 甲、乙、丙三个相同的恒容密闭容器中均充入0.3molH2和0.1molCO2,加入相同量的催化剂,反应温度T(甲)>T(乙)>T(丙),反应相同时间时,生成乙烯的产量一定为:甲>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | CO2 晶胞如图1所示,一个CO2 分子周围有12个CO2 分子紧邻 | |
| B. | 由E原子和F原子构成的气态团簇分子模型如图2所示,其分子式为EF或FE | |
| C. | H原子的电子云图如图3所示,H原子核外的大多数电子在原子核附近运动 | |
| D. | 金属Cu原子堆积模型如图4所示,该金属晶体为六方最密堆积,Cu原子的配位数为12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com