
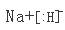
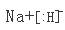


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
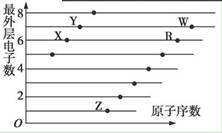
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:X>Y |
| D.X、Z形成的化合物中可能含有共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.原子半径:Y>Z>W |
| B.一定条件下,Y可置换出X |
| C.气态氢化物稳定性:Z>W |
| D.熔点YW2>XW4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si3N4(s) + 12HCl(g) △H<0
Si3N4(s) + 12HCl(g) △H<0 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.具有相同的原子序数 | B.原子核中具有相同的中子数 |
| C.具有相同的质量数 | D.原子核外电子总数相同 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.酸性:H3AsO4> H2SO4>H3PO4 | B.碱性:Ba(OH)2<Ca(OH)2<KOH |
| C.熔点:MgBr2<SiCl4<SiC | D.沸点:PH3<NH3<H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子的L层上的电子数为奇数的元素一定是主族元素 |
| B.同一周期的ⅡA族和ⅢA族元素的原子序数之差一定为1 |
| C.相邻两个周期的同一主族元素的原子序数之差等于上一周期所含元素种类 |
| D.主族序数等于周期序数的元素一定为金属元素 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
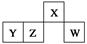
| A.原子半径:rW>rZ>rY>rX |
| B.含Y元素的盐溶液显酸性 |
| C.最简单气态氢化物的热稳定性:Z>W |
| D.X与氢元素组成的化合物XH5与水反应可产生两种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com