
【题目】请按要求回答下列问题。
I.请写出下列物质所含官能团的名称:
(1)CH3CH2CH2OH;___(2)CH2=CHCH2CH3;___
II.请写出下列物质所含官能团的结构简式:
(3)CH3CH2COOH;___(4)CH3CH2CH2Br;___
III.请按照系统命名法为下列物质命名:
(5)![]() ;___
;___
(6)![]() 。___
。___
IV.请按照要求画出相应的同分异构体:
(7)分子式为C5H10O的醛共有___种;在这些醛中,醛A的核磁共振氢谱中的信号数量最少(即峰数最少),A的结构简式是___。
(8)不考虑顺反异构的情况下,链状卤代烃C4H7Cl的同分异构体共有___种;若考虑顺反异构,链状卤代烃C4H7Cl的同分异构体共有___种。
【答案】羟基 碳碳双键 -COOH -Br 2,4-二甲基己烷 1,3-二丁醇 4 (CH3)3CCHO 8 11
【解析】
Ⅰ.(1)CH3CH2CH2OH的官能团名称为羟基;
(2)CH2=CHCH2CH3的官能团名称为碳碳双键;故答案为:羟基;碳碳双键;
Ⅱ.(3)CH3CH2COOH的官能团为-COOH;
(4)CH3CH2CH2Br的官能团为-Br;故答案为:-COOH;-Br;
Ⅲ.(5)![]() 按系统命名法命名的名称为:2,4-二甲基己烷;
按系统命名法命名的名称为:2,4-二甲基己烷;
(6)![]() 的名称为:1,3-二丁醇;故答案为:2,4-二甲基己烷;1,3-二丁醇;
的名称为:1,3-二丁醇;故答案为:2,4-二甲基己烷;1,3-二丁醇;
Ⅳ.(7)分子式为C5H10O的醛含有一个醛基,为饱和醛,当除了醛基的其他碳原子在一条直线上时,有2种结构,当有一条支链是有2中结构,故一共有4种;在这些醛中,醛A的峰数最少,说明氢原子种类最少,则A的结构简式是(CH3)3CCHO;
(8)不考虑顺反异构的情况下,链状卤代烃C4H7Cl中,若4个碳原子都在同一条直线则根据双键位置不同,有6种结构,当有一条支链时,有2种结构,所以链状卤代烃C4H7Cl的同分异构体共有8种;若碳碳双键两侧所连原子或原子团不同时,存在顺反异构,若考虑顺反异构,链状卤代烃C4H7Cl有3对顺反异构体,则链状卤代烃C4H7Cl的同分异构体共有11种;
故答案为:4;(CH3)3CCHO;8;11。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】在BaSO4饱和溶液中加入少量的BaCl2溶液产生BaSO4沉淀,若以Ksp表示BaSO4的溶度积常数,则平衡后溶液中( )
A.c(Ba2+)=c(SO42-)=![]()
B.c(Ba2+)·c(SO42-)>Ksp,c(Ba2+)=c(SO42-)
C.c(Ba2+)·c(SO42-)≠Ksp,c(Ba2+)<c(SO42-)
D.c(Ba2+)·c(SO42-)=Ksp,c(Ba2+)>c(SO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素W、X、Y、Z的原子序数依次增加,且均小于20。W、X、Y、Z的族序数之和为12;X与Y的电子层数相同;向过量的ZWY溶液中滴入少量胆矾溶液,观察到既有黑色沉淀生成又有臭鸡蛋气味的气体放出。下列说法正确的是( )
A. ZWY是离子化合物,既可以与酸反应又可以与碱反应
B. 晶体X熔点高、硬度大,可用于制造光导纤维
C. 原子半径由小到大的顺序为:![]()
D. 热稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列六种短周期元素(用字母x等表示)。最高正价或最低负价与原子序数关系如图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是______。已知x为非金属元素,由x、e、g三种元素组成的离子化合物的电子式:______。
(2)上述元素简单离子半径最大的是(用化学式表示,下同):___;比较g、h的最高价氧化物对应水化物的酸性强弱:_____。
(3)已知1mole的单质在足量d2中燃烧,恢复至室温,放出255.5 kJ热量,写出该反应的热化学方程式:__________。
(4)x和d组成的化合物中,既含有极性共价键又含有非极性共价键的是____(填化学式),此化合物可将碱性工业废水中的CN-氧化,生成碳酸盐和氨气,相应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室制备乙炔并进行性质验证的装置(夹持仪器己略去)。
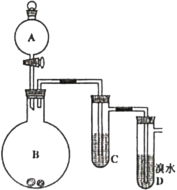
(1)实验室制备乙炔的方程式为___;
(2)仪器A的名称为___,为防止气体生成的速率过快,由A滴入B的试剂为___;
(3)装置C可选用的试剂为___(写出一种即可),其作用为___;
(4)反应开始后,D中的现象为___,所发生反应的反应类型为___;
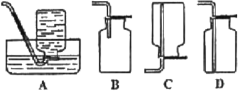
(5)D中验证实验结束后。B中反应仍在继续。此时可撤去装置D,在装置C之后连接收集装置,以下装置中最适合用于收集乙炔的是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将碳酸钠和碳酸氢钠的固体混合物Wg溶于水制成500mL溶液,钠离子的物质的量浓度为0.8mol·L-1,若将Wg该混合物用酒精灯加热至质量不再改变时,得到的固体物质的质量可能是
A. 21.2g B. 6.2g C. 8.4g D. 10.6g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.光照新制的氯水时,溶液的pH逐渐减小
B.高温,使N2和H2转化为更多的NH3(△H<0)
C.可用浓氨水和氢氧化钠固体快速制取氨气
D.增大压强,有利于SO2和O2反应生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用一直是研究课题。某地天然海水(主要含Na+、K+、Ca2+、Mg2+、Cl-、SO42-、Br-、CO32-、HCO3-等离子),研究用海水吸收燃煤排放的含有SO2烟气的工艺流程如图所示,下列说法中正确的是
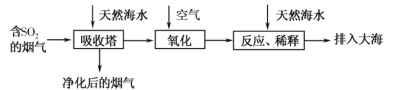
A.工艺中天然海水显酸性
B.氧化过程中可能发生的离子反应为2SO2+2H2O+O2=4H++2SO42-
C.排入大海的溶液与天然海水相比,只有SO42-数量发生了变化
D.若将氧化后的液体进行蒸发结晶,得到的晶体中CaSO4含量最高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com