
| A、引起空气发生化学变化 |
| B、产生杀菌消毒作用 |
| C、诱发动植物的基因突变 |
| D、造成病毒感染 |


科目:高中化学 来源: 题型:
| A、3.45g |
| B、2.3g |
| C、1.15g |
| D、0.575g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 温度 | 时间/min 物质的量 | 0 | 10 | 20 | 40 | 50 |
| 1 | 130℃ | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| 2 | 180℃ | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
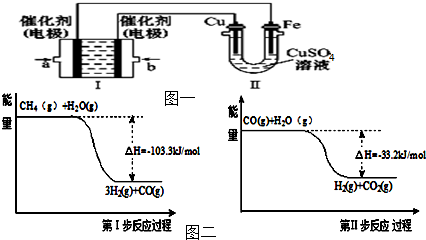
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | Ag+ Na+ |
| 阴离子 | NO3- SO42- Cl- |
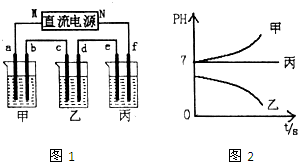
查看答案和解析>>
科目:高中化学 来源: 题型:
 用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题如图所示步骤分开五种离子.则溶液①、②、③、④是( )
用过量的H2SO4、NaOH、NH3、H2O、NaCl等溶液,按题如图所示步骤分开五种离子.则溶液①、②、③、④是( )| A、①NaCl ②NaOH ③NH2?H2O ④H2SO4 |
| B、①H2SO4 ②NaOH ③NH3?H2O ④NaCl |
| C、①H2SO4 ②NH3?H2O ③NaOH ④NaCl |
| D、①NaCl ②NH3?H2O ③NaOH ④H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用500mL容量瓶配制450mL 0.1 moL/L的氢氧化钠溶液,用托盘天平称取氢氧化钠固体1.8g |
| B、用量筒量取浓硫酸倒入小烧杯后,用蒸馏水洗涤量筒并将洗涤液转移至小烧杯中 |
| C、用量筒量取浓硫酸时,仰视读数 |
| D、其它环节正确,只是在定容时俯视容量瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com