
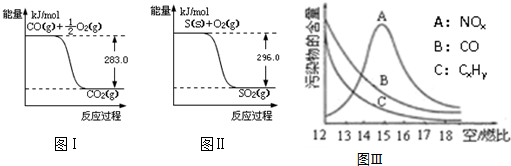
分析 (1)①Ni能与氧气反应;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
利用盖斯定律进行计算即可;
(2)根据所给反应的平衡常数,利用三段式法计算出平衡浓度减小求算,
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
来分析求解;
(3)①燃油气燃烧更充分;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应.
解答 解:(1)①Ni能与氧气反应,使Ni失去催化作用;
故答案为:避免O2与Ni反应再使其失去催化作用;
②由图I可知,O2(g)+2CO(g)=2CO2(g)△H=(-2×283)kJ•mol-1=-566kJ•mol-1,(i)
由图II可知,S(s)+O2(g)=SO2(g)△H=-296kJ•mol-1,(ii)
(i)-(ii)得:SO2(g)+2CO(g)=S(s)+2CO2(g)△H=-563-(-298)=-270kJ•mol-1,
故答案为:-270kJ/mol;
(2)设参加反应的CO的浓度为x
CO(g)+H2O(g)?CO2(g)+H2(g)
起始浓度(mol/L)0.30 0.30 0 0
转化浓度(mol/L) x x x x
转化浓度(mol/L)0.30-x 0.30-x x x
K=9.0=$\frac{{x}^{2}}{(0.30-x)^{2}}$,x=0.225,
所以CO的转化率α(CO)=$\frac{0.225mol/L}{0.30mol/L}$×100%=75%,
氢气反应速率v(H2)=$\frac{0.225mol/L}{5min}$=0.045mol/(L•min),
故答案为:75%;0.045mol/(L•min);
(3)①空/燃比增大,空气充分,可使燃油气燃烧更充分,以减少CO、CxHy含量,减少空气污染,
故答案为:空/燃比增大,燃油气燃烧更充分,故CO、CxHy含量减少;
②反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,反应 N2(g)+O2(g)?2NO(g) 不易进行,则导致NOx减少,
故答案为:因为反应 N2(g)+O2(g)?2NO(g) 是吸热反应,当空/燃比大于15后,由于燃油气含量减少,燃油气燃烧放出的热量相应减少,环境温度降低,使该反应不易进行,故NOx减少.
点评 本题考查较为综合,涉及催化剂、盖斯定律的应用、化学平衡常数的求算,为高考常见题型和高频考点,题目难度不大,侧重于考查学生的分析能力和对基础知识的应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.05mol/L | B. | 0.03mol/L | C. | 0.3mol/L | D. | 0.04mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(O2)=0.2mol/(L•s) | B. | v(SO3)=8mol/(L•min) | C. | v(SO2)=6mol/(L•min) | D. | v(O2)=6mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t2~t3 | t4~t5 | t5~t6 |
| K1 | K2 | K3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
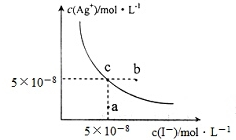
| A. | 在t℃时,Agl的Ksp=2.5×10-15 | |
| B. | 图中b点有碘化银晶体析出 | |
| C. | 向c点溶液中加入适量蒸馏水,可使溶液由c点到a点 | |
| D. | 在t℃时,反应AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常数K=200 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
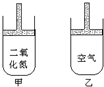 常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:
常温常压下在可移动活塞的甲、乙容器(如图)里分别充有等体积的二氧化氮(已建立了平衡:2NO2?N2O4;△H<0.)和空气,现分别进行下列两个实验:| A. | ①甲>乙②甲>乙 | B. | ①甲>乙②甲<乙 | C. | ①甲<乙②甲>乙 | D. | ①甲>乙②甲=乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
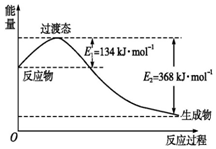 写出下列反应的热化学方程式
写出下列反应的热化学方程式查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com