
| A. | 浓硫酸具有吸水性,能干燥氢气,也能干燥氨气 | |
| B. | 乙醛具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化 | |
| C. | SO2具有漂白性,能使品红褪色,也能使酸性KMnO4溶液褪色 | |
| D. | 硝酸属于强酸,能与CaCO3反应生成CO2气体,也能与CaSO3生成SO2 |
分析 A.浓硫酸能与氨气反应;
B.醛基能被新制氢氧化铜、溴水等氧化;
C.SO2具有还原性,酸性KMnO4具有氧化性;
D.硝酸具有强氧化性能把CaSO3氧化为CaSO4.
解答 解:A.氨气是碱性气体,能与浓硫酸反应,不能用浓硫酸干燥,故A错误;
B.醛基能被新制氢氧化铜、溴水等氧化,乙醛含有醛基,具有还原性,能被新制氢氧化铜浊液氧化,也能被溴水氧化,故B正确;
C.SO2具有还原性,酸性KMnO4具有氧化性,SO2使酸性KMnO4溶液褪色表现了还原性,不表现漂白性,故C错误;
D.硝酸属于强酸,能与CaCO3反应生成CO2气体,但硝酸具有强氧化性能把CaSO3氧化为CaSO4,所以硝酸与CaSO3反应没有SO2气体生成,故D错误.
故选B.
点评 本题考查了硫的化合物的性质、硝酸的性质、醛的性质,侧重于常见物质的性质的考查,题目难度不大,注意把握二氧化硫的漂白性和还原性.


科目:高中化学 来源: 题型:多选题
| A. | 用氨水鉴别Al3+、Mg2+和Ag+ | |
| B. | 用盐酸、BaCl2溶液鉴别Cl-、SO42-和CO32- | |
| C. | 用溴水鉴别CH4和C2H4 | |
| D. | 用KMnO4酸性溶液鉴别CH3CH2OH和CH3CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
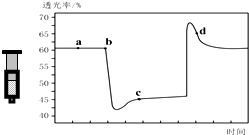 已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )
已知反应:2NO2 (红棕色)?N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( )| A. | b点的操作是压缩注射器 | |
| B. | c点与a点相比,c(NO2)增大,c(N2O4)减小 | |
| C. | d 点:v(正)>v(逆) | |
| D. | 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| I1/KJ•mol-1 | I2/KJ•mol-1 | I3/KJ•mol-1 | I4/KJ•mol-1 | I5/KJ•mol-1 |
| 738 | 1451 | 7733 | 10540 | 13630 |
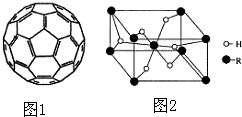
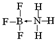 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,则c (Na+)+c(H+)=c(OH-)+c(CH3COO-) | |
| B. | 等物质的量浓度的NH4HSO4、NH4HCO3溶液中c(NH4+)大小:NH4HSO4>NH4HCO3 | |
| C. | 0.1 mol/L HA(某酸)溶液pH≠1,0.1 mol/L BOH(某碱)溶液中c(OH-)=0.1 mol/L,则BA(盐)溶液pH<7 | |
| D. | 4种pH相同的溶液①CH3COONa ②C6H5ONa ③NaHCO3 ④NaOH中c(Na+)的大小顺序是①>②>③>④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
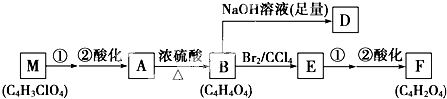
 +(2n-1)H2O.
+(2n-1)H2O.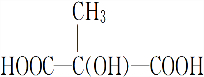 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的二元弱酸H2R溶液与 pH=11的NaOH溶液混合后,混合液的pH等于7,则混合液中c(R2-)>c(Na+)>c(HR-) | |
| B. | 将0.2 mol/L的某一元弱酸HA溶液和0.1mol/L NaOH溶液等体积混合后溶液中存在:2c(OH-)+c(A-)=2c(H+)+c(HA) | |
| C. | 某物质的水溶液中由水电离出的c(H+)=1×10-amol/L,若a>7,则该溶液的pH为a或14-a | |
| D. | 相同温度下,0.2mol/L的醋酸溶液与0.1mol/L的醋酸溶液中c(H+)之比小于2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=6的NaHSO4溶液:c(Na+)+c(H+)=2c(SO42-)+c(OH-) | |
| B. | 0.1 mol/L NaHCO3溶液加水稀释后,c(H+)与c(OH-)的乘积不变 | |
| C. | pH相同的①CH3COONa、②NaClO二种溶液的c(Na+):①>② | |
| D. | 0.1 mol/L Na2SO3溶液:c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com