
| A. | 标准状况下,22.4L甲醛完全燃烧产生NA个CO2分子 | |
| B. | 1L1mol/L Na2CO3溶液中,阴离子个数等于NA | |
| C. | 100 g 98%的浓硫酸中含氧原子个数为4NA | |
| D. | 常温常压下,1mol白磷中含有共价键为4NA |
分析 A、求出甲醛的物质的量,然后根据1mol甲醛中含1molC原子来分析;
B、碳酸钠溶液中,碳酸根离子部分水解生成了氢氧根离子,阴离子数目增加;
C、硫酸溶液中,除了硫酸本身,水也含氧原子;
D、1mol白磷中含6molP-P键.
解答 解:A、标况下22.4L甲醛的物质的量为1mol,而甲醛中含1个碳原子,故1mol甲醛中含1mol碳原子,燃烧生成1mol二氧化碳即NA个二氧化碳分子,故A正确;
B、1L1mol/L Na2CO3溶液中含有溶质碳酸钠的物质的量为1mol,由于溶液中碳酸根离子部分水解生成氢氧根离子,导致溶液中阴离子数目增加,所以溶液中阴离子个数大于NA,故B错误;
C、硫酸溶液中,除了硫酸本身,水也含氧原子,故溶液中的氧原子的个数大于4NA个,故C错误;
D、1mol白磷中含6molP-P键,即6NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
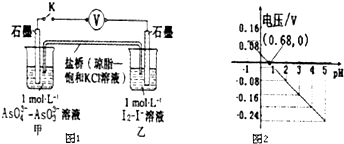
| A. | 调节pH可以改变反应的方向 | |
| B. | pH=0.68 时,反应处于平衡状态 | |
| C. | pH=5 时,负极电极反应式为2I--2e-═I2 | |
| D. | pH>0.68时,氧化性I2>AsO${\;}_{4}^{3-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )
某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和溶液.下列说法正确的是( )| A. | a电极上发生的反应为:MnO4-+8H++5e-═Mn2++4H2O | |
| B. | 外电路电子的流向是从a到b | |
| C. | 电池工作时,盐桥中的SO42-移向甲烧杯 | |
| D. | b电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{(m-n)}$mL | B. | $\frac{(m-n)}{3}$ mL | C. | $\frac{(4m-1)}{13}$ mL | D. | $\frac{(m-n)}{3}$3 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,用pH计测定0.1mol/L的甲酸钠溶液pH为13 | |
| B. | 向饱和醋酸钠溶液中添加0.1mol/L的碳酸钠溶液产生了无色气体 | |
| C. | 少量Mg(OH)2沉淀中加入氯化铵浓溶液可以观其察到白色沉淀溶解 | |
| D. | 向2ml 1mol/L的NaOH溶液中加入3滴 1mol/L MgCl2溶液,再加入3 滴1mol/L FeCl3溶液可以证明Mg(OH)2沉淀转变成Fe(OH)3沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、Ag+ | B. | H+、HCO3-、Na+、Cl- | ||
| C. | Na+、OH-、Ba2+、CO32- | D. | Mg2+、Cl-、H+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
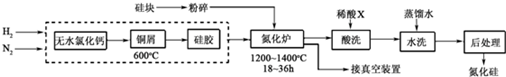
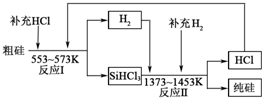
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com