

分析 (1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$,由此分析解答;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2进行计算;(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH;
(5)盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度较大;溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,故II应为醋酸稀释时的pH值变化曲线,利用a点、c点溶液中的离子浓度来分析导电性;醋酸浓度大于盐酸,则醋酸中和氢氧化钠溶液的能力强于盐酸;结合升高温度醋酸的电离程度增大分析$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$变化.
解答 解:(1)①4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H1=-907.28kJ•mol-1;②4NH3(g)+3O2(g)═2N2(g)+6H2O(g)△H2=-1 269.02kJ•mol-1;目标反应的反应热为:$\frac{②×5-①×3}{2}$=1811.63 kJ•mol-1,
故答案为:-1811.63 kJ•mol-1;
②温度相同时p1的一氧化氮的氮率大,所以增大压强平衡正向移动,所以p1>p2;α(NO)几乎为0的原因是无二氧化氮,NO2几乎完全分解;
故答案为:>;NO2几乎完全分解;
(2)联合制碱工艺示意图如图2所示,“碳化”时发生反应的化学方程式为CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1,
故答案为:CO2+NH3+H2O+NaCl═NaHCO3↓+NH4C1;
(3)电极b的电极发生还原反应,二氧化氮转化生成氮气,电极反应式为2NO2+8e-+4H2O═8OH-+N2;标准状况下4.48L NH3的物质的量为:0.2mol,根据4NH3~3NO2,所以被消除的NO2的物质的量为$\frac{3}{4}$=0.15mol,
故答案为:2NO2+8e-+4H2O═8OH-+N2;0.15;
(4)NaHS再与NaVO3反应生浅黄色沉淀是硫单质和Na2V4O9,根据得失电子守恒,得化学方程式为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH,
故答案为:2NaHS+4NaVO3+H2O═Na2V4O9+2S↓+4NaOH.
(5)A.溶液稀释时,醋酸进一步电离,其溶液中氢离子浓度大于盐酸的离子浓度,故曲线I代表盐酸的稀释过程、II应为醋酸稀释时的pH值变化曲线,故A正确;
B.稀释后盐酸溶液中氯离子、氢离子浓度减小,则溶液导电性较弱,故a溶液的导电性比c溶液的导电性强,故B正确;
C.醋酸的浓度大于盐酸,则a点溶液中和氢氧化钠溶液的能力小于b,故C错误;
D.升高温度后,醋酸的电离程度增大,醋酸根离子浓度增大,而氯离子浓度基本不变,则$\frac{c(C{l}^{-})}{c(C{H}_{3}CO{O}^{-})}$的比值减小,故D正确;
故选C.
点评 本题考查盖斯定律的应用、依据图象分析平衡移动的原因、及电极反应式书写、酸碱混合的定性判断及溶液pH的计算,考查范围广,易错题为(3)题,会根据化合价的变化确定NO2的电极,然后书写电极反应式,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中,伴随着物质的变化,既有化学键的断裂又有化学键的形成,还有化学能的改变 | |
| B. | 在化学反应过程中是放出热量还是吸收热量,取决于反应物总能量与生成物总能量的相对大小 | |
| C. | 需要加热的化学反应,该化学反应过程一定是吸收能量 | |
| D. | 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:Y>X | |
| B. | 气态氢化物的稳定性:Z>M | |
| C. | 简单离子半径由大到小的顺序是Z>Y>M | |
| D. | X与Z可以形成原子个数比1:1的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某品牌果冻标签如图所示.回答下列问题:
某品牌果冻标签如图所示.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X与Y形成的两种常见化合物中阴、阳离子的个数比均为l:2 | |
| B. | Y的氢化物比R的氢化物稳定,沸点高 | |
| C. | Y分别与Z、W、R以两种元素组成的常见化合物有3种 | |
| D. | Z、W、R最高价氧化物对应水化物的酸性由强到弱顺序是:R>W>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a与氢元素能形成原子个数之比为1:1的化合物 | |
| B. | b单质能与水、无水乙醇反应 | |
| C. | c3+与d-的最外层电子数和电子层数都不相同 | |
| D. | a与d可形成含有极性共价键的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
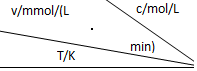 | 0.600 | 0.500 | 0.400 | 0.300 |
| 318.2 | 3.60 | 3.00 | 2.40 | 1.80 |
| 328.2 | 9.00 | 7.50 | a | 4.50 |
| b | 2.16 | 1.80 | 1.44 | 1.08 |
| A. | a=6.00 | |
| B. | 不同温度时,蔗糖浓度减少一半所需的时间相同 | |
| C. | b<318.2 | |
| D. | 同时改变反应温度和蔗糖的浓度,v可能不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验事实 | 结论 | |
| A | 向某溶液中滴入2滴KSCN溶液,溶液不显血红色.再向溶液中滴入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl,2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>2ClO3->IO3- |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
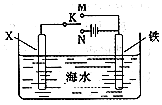 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com