
【题目】在含有大量K+、OH-、CO32-的溶液中还可能大量存在的离子是
A. NO3- B. HCO3- C. Mg2+ D. Cu2+
 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,某气态平衡体系的平衡常数表达式为K=![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A. 升高温度,平衡常数K一定增大
B. 增大A浓度,平衡向正反应方向移动
C. 增大压强,C体积分数增加
D. 升高温度,若B的百分含量减少,则正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的固定有三种途径:生物固氮、自然固氮和工业固氮。根据最新“人工固氮”的研究报道:在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生反应,生成的主要产物为NH3。进一步研究NH3生成量与温度的关系,部分平衡时实验数据见下表(光照、N2压力1.0×105Pa、反应时间1 h):
T/K | 303 | 313 | 323 | 353 |
NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
相应的化学方程式:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=a kJ·mol-1
4NH3(g)+3O2(g) ΔH=a kJ·mol-1
回答下列问题:
(1)此合成反应的a________0;(填“>”、“<”或“=”)
(2)从323 K到353 K,氨气的生成量减少的可能原因是_______________________________;(3)与目前广泛使用的工业合成氨方法相比,该方法固氮反应速率慢。请提出可提高其反应速率且增大NH3生成量的建议__________________________________________________。
(4)工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:
2NH3(g) ΔH=-92.4 kJ·mol-1,分别研究在T1、T2和T3(T1<T2<T3)三种温度下合成氨气的规律。下图是上述三种温度下不同的H2和N2的起始组成比(起始时N2的物质的量均为1 mol)与N2平衡转化率的关系。请回答:

①在上述三种温度中,曲线X对应的温度是________。
②a、b、c三点中H2的转化率最小的是_______点、转化率最大的是________点。
③在容积为1.0 L的密闭容器中充入0.30 mol N2(g)和0.80 molH2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为4/7。该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数为__________________。
N2(g)+3H2(g)的平衡常数为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙烯并进行性质实验,装置如图,下列说法错误的是
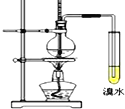
A. 乙醇发生消去反应生成乙烯
B. 实验中溴水褪色即可证明产生了乙烯
C. 制取乙烯反应中浓硫酸的主要作用为催化剂和脱水剂
D. 控制该反应温度在170℃左右,有利于减少副反应发生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏伽德罗常数的数值为,下列叙述正确的是( )
A.标准状况下,22.4L四氯化碳含有的分子数为NA
B.1 mol硫酸钾中阴离子所带的电荷数为2NA
C.0.5 molL﹣1NaOH溶液中 Na+数为0.5NA
D.常温常压下,16g氧气所含电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,对于pH=11的氨水,下列判断正确的是
A. 该氨水的浓度为1.0×10-3mol·L-1
B. 加水稀释,溶液中所有离子的浓度均减小
C. 加水稀释,溶液中c(NH4+)/c(NH3·H2O)变大
D. 与pH=3的盐酸等体积混合,反应后溶液pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,溶液中能发生如下反应:①2R-+Z2===R2+2Z- ②16H++10Z-+2XO![]() ===2X2++5Z2+8H2O ③2M2++R2===2M3++2R-。由此判断,下列说法中正确的是( )
===2X2++5Z2+8H2O ③2M2++R2===2M3++2R-。由此判断,下列说法中正确的是( )
A. Z2+2M2+===2M3++2Z-不可以进行
B. Z元素在①②反应中都发生还原反应
C. X2+是还原剂XO4—的还原产物
D. 各粒子氧化性由强到弱的顺序是XO![]() >Z2>R2>M3+
>Z2>R2>M3+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com