
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
分析 根据单质中元素的化合价为0,在化合物中正负化合价的代数和为0来解答.
解答 解:NH4NO3中氨根为+1价,硝酸根为-1价,氢为+1价,则氨根中N元素的化合价为-3价,硝酸根中N元素的化合价为+5价;
N2为单质,则N元素的化合价为0;
NO2中O为-2价,由化合物中正负化合价的代数和为0,则N元素的化合价为+4价;
NO中O为-2价,由化合物中正负化合价的代数和为0,则N元素的化合价为+2价;
则N元素表现出的化合价共有5中,分别为-3价、+5价、0、+4价、+2价,
故选D.
点评 本题考查元素的常见化合价,可根据单质中元素的化合价为0,在化合物中正负化合价的代数和为0利用常见的元素的化合价分别求出不同物质中N元素的化合价来解答,题目难度不大.


 学习实践园地系列答案
学习实践园地系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2与D2 | B. | T2O与H2O | ||
| C. | ${\;}_{19}^{40}$K与${\;}_{19}^{39}$K | D. | 金刚石与石墨 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
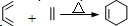
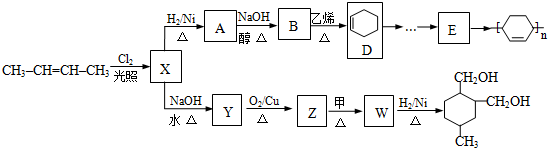
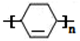
 ;Z→W
;Z→W .
.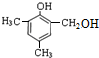 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 18ml | B. | 大于18ml | C. | 小于18ml | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16 g | B. | 32 g | C. | 16 | D. | 32 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能被银氨溶液氧化 | |
| B. | 能使KMnO4酸性溶液褪色 | |
| C. | 1mol该有机物只能与1mol H2发生加成反应 | |
| D. | 1mol该有机物只能与1mol Br2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com