
下列有关丙烯酸(CH2=CHCOOH)的说法正确的是
A. 丙烯酸使溴水褪色属于氧化反应
B. 丙烯酸能发生加成反应但不能发生取代反应
C. 丙烯酸分子中所有碳原子不可能处于同一平面
D. 反应 CH2=CHCOOH+H2 CH3CH2COOH的原子利用率为100%
CH3CH2COOH的原子利用率为100%
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源:2017届四川省广元市高三第二次高考适应性统考理综化学试卷(解析版) 题型:简答题
氰化钠是一种重要的化工原料。泄漏时会导致环境污染,可以通过喷洒双氧水或硫代硫酸钠溶液来处理。
(1)NaCN的电子式为_______。
(2)NaCN与双氧水反应为:NaCN+H2O2+H2O=NaHCO3+NH3↑,用H2O2处理1molNaCN时,反应中转移电子的物质的量为______mol。
(3)NaCN也能被酸性高锰酸钾溶液氧化,产生对大气无污染的气体和Mn2+,该反应的离子方程式是____________。
(4)某化学兴趣小组在实验室制备硫代硫酸钠(Na2S2O3),并检测用硫代硫酸钠溶液处理后的氰化钠废水能否达标排放。
I.实验室通过下图装置制备Na2S2O3。
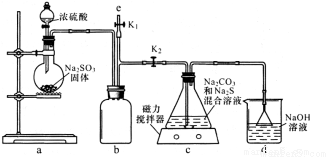
①装置中盛浓硫酸的仪器是_____,b装置的作用是________________。
②c装置中的产物有Na2S2O3和CO2等,d装置中的溶质有NaOH、Na2CO3,还可能有____________。
③实验结束后,在e处最好连接盛NaOH溶液的容器,再________________(填具体操作),最防止拆除装置时污染空气。
Ⅱ.测定用硫代硫酸钠溶液处理后的废水中氰化钠的含量。
已知:①废水中氰化钠的最高排放标准为0.50 mg/L。
②Ag++2CN-=[Ag(CN)2]-,Ag++I-=AgI↓,AgI呈黄色,且CN-优先与Ag+反应。
③实验如下:取15.00 mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.000 ×10-4 mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50 mL。
④滴定终点的判断方法是_______________。
(7)经计算处理后的废水中NaCN的浓度为________mg/L(保留两位小数),处理后的废水是否达到排放标准____________(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:简答题
Ⅰ.在恒温条件下,将一定量X和Y的混合气体通入一容积为2 L的密闭容器中,X和Y两物质的浓度随时间变化情况如下图。
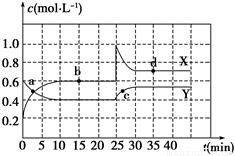
(1)该反应的化学方程式为(反应物或生成物用符号X、Y表示):____________________。
(2)0~10min化学反应速度V(X)=__________________。
(3)比较Y在0~10min和10~20min时平均反应速率的大小:v(0~10)_______ v(10~20)(填“<”、“>”或“=”),原因是________________。
(4) a、b、c、d四个点中,表示化学反应处于平衡状态的点是_________,理由是__________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年广西省桂林市高一下学期开学考化学试卷(解析版) 题型:选择题
将30mL 0.5mol/L NaOH 溶液加水稀释到500mL ,稀释后溶液中NaOH的物质的量浓度为( )
A. 0.3 mol/L B. 0.03 mol/L C. 0.05 mol/L D. 0.04 mol/L
查看答案和解析>>
科目:高中化学 来源:2017届云南省高三下学期第一次统测理综化学试卷(解析版) 题型:简答题
中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:
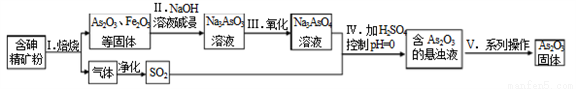
回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中
电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二〜图四所示。
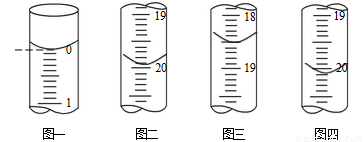
①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:填空题
某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。
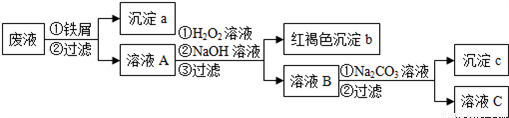
请回答:
(1)沉淀a中含有的单质是_________;
(2)沉淀b的化学式是__________;
(3)沉淀c的化学式是__________;
(4)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_______________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山东省高一下学期开学考试化学试卷(解析版) 题型:选择题
下列离子方程式书写正确的是( )
A. 向Al2(SO4)3溶液中加入过量氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ + 2H2O
B. 将氨气通入盐酸中:NH3 + H+ = NH4+
C. 将铜箔投入氯化铁溶液中:Fe3+ + Cu = Fe2+ + Cu2+
D. 向NaHSO4溶液滴加Ba(OH)2溶液至溶液恰好呈中性:H++OH-+Ba2++SO42-═BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源:2017届广西省桂林市、崇左市高三联合调研考试理科综合化学试卷(解析版) 题型:简答题
PbO主要用做电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体。下图是用某工业废渣(含PbSO435%,其余为CaSO4)生产PbO的主要流程。
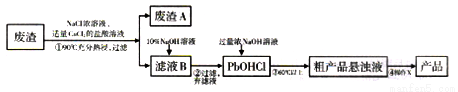
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是__________________(填化学式)。
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为_______;加入CaCl2的目的是________________。
(3)“滤液B→PbOHCl”的离子方程式为_________________。
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)__________、___________、过滤、干燥。
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为_______(保留三位有效数字)。(已知:Pb2++H2Y=PbY+2H+)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高一3月月考化学试卷(解析版) 题型:选择题
下列有关说法正确的是( )
A. 次氯酸钙溶液中通入少量SO2气体的离子方程式: Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO
B. CaCl2既含有离子键,又含有非极性键。
C. SO2使KMnO4酸性溶液和滴有酚酞的NaOH溶液褪色的原理相同。
D. 将铁屑溶于过量盐酸后,再加入硝酸锌,会有三价铁生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com