
| A. | AlCl3 溶液与烧碱溶液反应,当 n(OH-):n(Al3+)=7:2 时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2 溶液与 NaHS 溶液反应,当 n(CuCl2):n(NaHS)=1:2 时 Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2 与 FeBr2 溶液反应,当 n(Cl2):n(FeBr2)=1:1 时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe 与稀硝酸反应,当 n(Fe):n(HNO3)=1:2 时,3 Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
分析 A.AlCl3 溶液与烧碱溶液反应,少量氢氧化钠溶液反应时,发生反应:AlCl3+3NaOH=Al(OH)3↓+3NaCl,氢氧化钠过量,发生Al(OH)3+NaOH=NaAlO2+2H2O;
B.CuCl2 溶液与 NaHS 溶液当 n(CuCl2):n(NaHS)=1:2 时,反应生成硫化铜和硫化氢;
C.向FeBr2溶液中通入Cl2,Fe2+还原性大于Br-,氯气首先把Fe2+氧化为Fe3+,过量Cl2,二者反应生成氯化铁、溴;
D.过量的铁与稀硝酸反应生成硝酸亚铁,若铁不足时生成硝酸铁.
解答 解:A.AlCl3 溶液与烧碱溶液反应,当 n(OH-):n(Al3+)=7:2 时,假设Al3+为2mol,生成Al(OH)3,需氢氧化钠6mol,剩余1mol氢氧化钠,溶解1molAl(OH)3,离子方程式为2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O,故A正确;
B.NaHS 溶液为二元弱酸氢硫酸的酸式盐,当 n(CuCl2):n(NaHS)=1:2 时,CuCl2 溶液与 NaHS 溶液反应,生成硫化铜和硫化氢,离子方程式为:Cu2++2HS-═CuS↓+H2S↑,故B正确;
C.Cl2 与 FeBr2 溶液反应,因还原性:Fe2+>Br-,氯气先氧化Fe2+,再氧化Br-,当 n(Cl2):n(FeBr2)=1:1 时,离子方程式为2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2,故C错误;
D.过量的铁与稀硝酸反应生成硝酸亚铁:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,若铁不足时生成硝酸铁:Fe+4H++NO3-═Fe3++NO↑+2H2O,Fe 与稀硝酸反应,当 n(Fe):n(HNO3)=1:2 时,铁过量,发生反应:3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O,故D正确;
故选C.
点评 本题考查了离子方程式书写判断,题目难度中等,明确离子方程式的书写原则及发生反应实质为解答关键,注意掌握反应物过量情况对生成产物的影响,试题培养了学生灵活应用基础知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 能使pH试纸变深蓝色的溶液:Na+、AlO2-、S2-、CO32- | |
| B. | Na2S溶液中:K+、Na+、NO3-、Ag+ | |
| C. | 含有大量Al3+的水溶液中:Na+、NH4+、HCO3-、Br- | |
| D. | 水电离产生的H+浓度为1×10-12mol•L-1的溶液:NH4+、Na+、Cl-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子晶体 | B. | 原子晶体 | C. | 分子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 船舶外壳装上锌块,是利用牺牲阳极的阴极保护法进行金属防腐 | |
| B. | 埃博拉病毒可用乙醇、次氯酸钠溶液、双氧水消毒,其消毒原理相同 | |
| C. | 压缩天然气(CNG)、液化石油气(LPG)的主要成分是烃类,是城市推广的淸洁燃料 | |
| D. | 2016年9月,中国太钢集团造出的圆珠笔头,可完全替代进口笔尖,该笔尖钢为合金,且具有良好的切削性 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
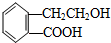 ,它可通过不同化学反应分别制得B、C、D和E四种物质.
,它可通过不同化学反应分别制得B、C、D和E四种物质.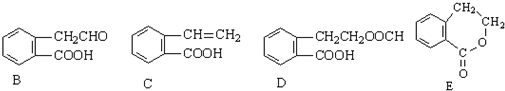
 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O.
+2H2O. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,56g由N2和CO组成的混合气体含有的原子数目为4 NA | |
| B. | 高温下,0.2 molFe与足量水蒸气反应,生成的H2分子数为0.3NA | |
| C. | 1 L 1.0mol•L-1的NaAlO2水溶液中含有的总原子数为2NA | |
| D. | 1 mol羟基中含有的电子数为10NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com