
| A. | 氢氧化铯是一种强碱,比KOH的碱性强 | |
| B. | 铯与水或酸溶液反应剧烈,都生成氢气 | |
| C. | Cs的还原性比Na强,故Na+的氧化性大于Cs+ | |
| D. | Al的金属性大于Cs的金属性 |
分析 依据同主族元素性质的递变规律可知,同主族元素从上到下元素金属性依次增强,元素金属性越强,单质的还原性、最高价氧化物对应水化物的碱性、与水反应的剧烈程度就越强,由此分析解答.
解答 解:A.铯与钾同主族,铯排在钾的下边,所以金属性强于钾,所以CsOH是一种强碱,比KOH的碱性强,故A正确;
B.钠与水或者酸能剧烈的反应产生氢气,铯与钠同主族,铯排在钠的下边,所以金属性强于钠,与水或酸溶液反应更剧烈,故B正确;
C.单质的还原性越强,对应阳离子的氧化性就越弱,Cs的还原性比Na的强,所以Na+的氧化性强于Cs+,故C正确;
D.铯与钠同主族,铯排在钠的下边,所以金属性强于钠,更强于铝,故D错误;
故选:D.
点评 本题考查了碱金属的性质,题目难度不大,熟悉同主族元素性质的递变规律是解题关键.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 某烷烃的命名为:2-甲基-3-乙基丁烷 | |
| B. | 分子式为 C4H8O2的酯有 4 种 | |
| C. | 乙烯分别使溴水和酸性 KMnO4 溶液褪色,反应类型相同 | |
| D. | 油脂是能发生水解反应的高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=2的1.0 L H2SO4溶液中含有H+的数目为0.02 NA | |
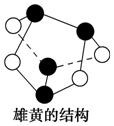
| B. | 0.5 mol雄黄(As4S4,所有原子都满足8电子结构,结构如图)含有NA个S-S键 | |
| C. | 39 g苯分子中共含6 NA个共价单键 | |
| D. | 向FeI2、NaBr的混合溶液中通入适量氯气,当有1 molFe2+被氧化时,该反应转移电子的数目至少为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:
实验室需要0.1mol/LNaOH溶液450ml和0.51mol/L硫酸溶液500ml,根据这两种溶液的配制情况回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
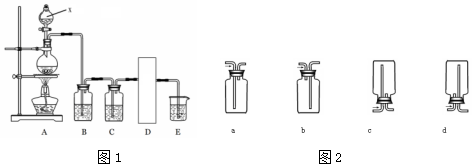
 MnCl2+Cl2↑+2H2O.
MnCl2+Cl2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H2、I2、HI三种气体组成的平衡体系加压后颜色变深 | |
| B. | 对2SO2+O2?2SO3△H<0的反应,使用催化剂可加快反应的速率 | |
| C. | 实验室可用浓氨水和氢氧化钠固体快速制取氨气 | |
| D. | N2(g)+3H2(g)?2NH3(g)△H<0,500℃左右比室温更有利于合成NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com