
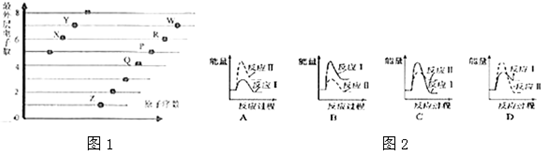
分析 都是短周期元素,由最外层电子数与原子序数关系可知,X、Y处于第二周期,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、P、Q、R、W处于第三周期,最外层电子数分别为1、4、5、6、7,故Z为Na元素、Q为Si、P为P元素、R为S、W为Cl元素,据此进行解答.
解答 解:由最外层电子数与原子序数关系可知,X、Y处于第二周期,X的最外层电子数为6,故X为O元素,Y的最外层电子数为7,故Y为F元素;Z、P、Q、R、W处于第三周期,最外层电子数分别为1、4、5、6、7,故Z为Na元素、Q为Si、P为P元素、R为S、W为Cl元素,
(1)Y是F,F在元素周期表中位于第二周期,第VIIA族,P为磷,P的基态原子核外电子排布式为,故答案为:二;VIIA;122s22p63s23p2;
(2)F,P,S元素的非金属性越强,其第一电离能越大,由于P元素的3p处于半充满状态,故其第一电离能大于S,故第一电离能大小的顺序为:F>P>S,O,S,Cl的气态氢化物分别为:H2O、H2S、HCl,水呈中性、HCl为强酸,故水溶液酸性大小顺序为:HCl>H2S>H2O,故答案为:F>P>S;HCl>H2S>H2O;
(3)O,Na的单质按物质的量比1:2反应生成的化合物为过氧化钠,过氧化钠中化学键类型有离子键、共价键,2mol过氧化钠与标准状况下1.5molCO2和1.0mol水蒸气混合物充分反应,反应方程式为:2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,据此关系式得出:1.5molCO2和1.0mol物质的量大于过氧化钠的物质的量,且每1mol过氧化钠反应转移1mol电子,由于过氧化钠不足,故转移电子的物质的量是2mol×1=2mol,故答案为:离子键、共价键;2mol;
(4)Si单质与Na的最高氧化物对应水化物(NaOH)的浓溶液反应生成硅酸钠和氢气,化学方程式为:Si+2NaOH+H2O=Na2SiO3+2H2↑,故答案为:Si+2NaOH+H2O=Na2SiO3+2H2↑;
(5)反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、C错误,因为两图中生成物总能量高于反应物总能量,由题意知:反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则反应Ⅱ的活化能较大,则B错误、D正确,故选D.
点评 本题考查结构性质位置关系、元素周期律等,难度不大,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:解答题
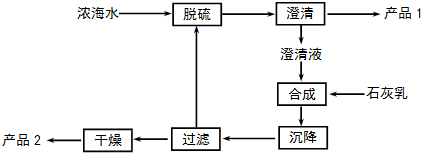
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
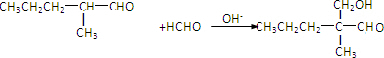 .
.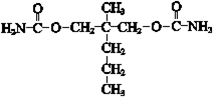 .
.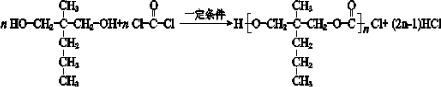 .
.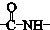 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是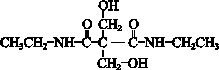 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝需经过特别处理能具有抗腐蚀能力 | |
| B. | “地沟油”经过加工处理可用来制肥皂 | |
| C. | 嫦娥系列卫星中使用的碳纤维,是一种新型无机非金属材料 | |
| D. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
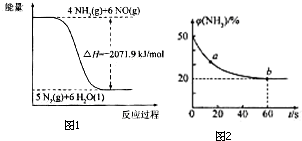 合理应用和处理氮的化合物,在生产生活中有重要意义.
合理应用和处理氮的化合物,在生产生活中有重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )
在密闭容器中,1molH2与1molCO发生反应:CO(g)+2H2(g)?CH3OH(g),△H<0,反应达到平衡时,改变温度(T)和压强(P),反应混合物中甲醇的物质的量分数变化情况如图所示,下列说法正确的是( )| A. | P1<P2<P3<P4 | |
| B. | T1<T2<T3<T4 | |
| C. | T4和P1状态下,H2的平衡转化率为8/9 | |
| D. | 甲醇的物质的量分数越小,反应的平衡常数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝与V2O5发生铝热反应 | B. | 镁粉投入到FeCl3溶液中 | ||
| C. | 碳粉与CuO混合物在试管中加热 | D. | 水蒸气通入足量Na2O2粉末 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
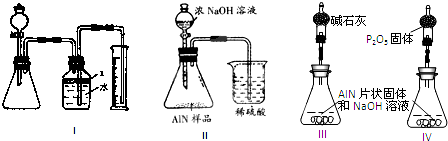
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

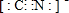
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com