下列有关叙述正确的是( )
A.常温下,由NH4Cl和NH3?H2O组成的混合液pH一定大于7
B.18g由14C原子形成的甲烷中所含有的C─H键的个数为4NA
C.向2mol/L的CH3COOH溶液中加入等体积1mol/L的NaOH溶液后的混合液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.某温度时,在恒容的容器中反应2SO2(g)+O2(g)?2SO3(g)达到平衡时,向体系中充入SO2气体,平衡向正反应方向移动,SO2的转化率提高
【答案】
分析:A.常温下,由NH
4Cl和NH
3?H
2O组成的混合液pH不一定大于7;
B.每个甲烷分子中含有4个碳氢键,根据甲烷的物质的量计算碳氢键个数;
C.向2mol/L的CH
3COOH溶液中加入等体积1mol/L的NaOH溶液,醋酸和氢氧化钠反应后,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸钠的水解程度;
D.平衡后,向容器中加入二氧化硫平衡向正反应方向移动,但二氧化硫的转化率降低.
解答:解:A.常温下,由NH
4Cl和NH
3?H
2O组成的混合液pH不一定大于7,也可能等于7,如果溶液中氢离子和氢氧根离子浓度相等,则溶液呈中性,故A错误;
B.每个甲烷分子中含有4个碳氢键,18g由
14C原子形成的甲烷的物质的量=
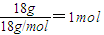
,所以18g由
14C原子形成的甲烷中所含有的C─H键的个数为4N
A,故B正确;
C.向2mol/L的CH
3COOH溶液中加入等体积1mol/L的NaOH溶液,醋酸和氢氧化钠反应后,溶液中的溶质是等物质的量浓度的醋酸和醋酸钠,醋酸的电离程度大于醋酸钠的水解程度,所以c(CH
3COO
-)>c(CH
3COOH),故C错误;
D.平衡后,向容器中加入二氧化硫平衡向正反应方向移动,氧气的转化率增大,但二氧化硫的转化率降低,故D错误;
故选B.
点评:本题考查了弱电解质的电离、阿伏伽德罗常数的计算、离子浓度大小的比较等知识点,易错选项是B,注意碳原子的相对原子质量是14而不是12,为易错点.

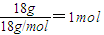 ,所以18g由14C原子形成的甲烷中所含有的C─H键的个数为4NA,故B正确;
,所以18g由14C原子形成的甲烷中所含有的C─H键的个数为4NA,故B正确;
