


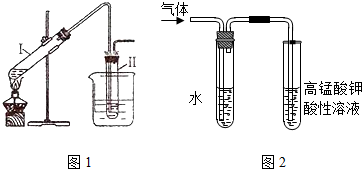
分析 (1)根据装置图分析:a为三颈烧瓶;
(2)装置b中将活塞上下部分连通,能平衡上下气压;
(3)浓硫酸具有强氧化性和脱水性,温度高能使有机物氧化和脱水碳化;
(4)混合物接触时间越长,使反应物接触越充分;
(5)间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL (0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算求出理论产量,再求出产率.
(6)实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯;为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,据此分离混合物.
解答 解:(1)由装置图分析可知a为三颈烧瓶,b为恒压滴液漏斗,
故答案为:三颈烧瓶;
(2)装置中装置b中将活塞上下部分连通具有平衡气压的作用,使漏斗中间甲苯酚30mL(0.29mol)和乙酰乙酸乙酯26.4mL (0.21mol)的混合物顺利流下,
故答案为:平衡上下气压,使漏斗中液体顺利流下;
(3)浓硫酸具有强氧化性和脱水性,反应温度高浓硫酸能使有机物氧化和脱水碳化,发生副反应,所以浓H2SO4需要冷却至0℃以下,
故答案为:防止浓硫酸将有机物氧化和炭化;
(4)不断的搅拌反应混合物,可以使反应物充分接触反应,从而提高反应产率,
故答案为:使反应物充分接触反应,提高反应产率;
(5)已知间甲苯酚30mL(0.29mol)、乙酰乙酸乙酯26.4mL(0.21mol),若完全反应间甲苯酚过量,按照乙酰乙酸乙酯计算理论产量为0.21mol×174g/mol=36.54g,则产率为$\frac{33.0g}{36.54g}$×100%≈90.3%,
故答案为:90.3%;
(6)实验室用乙醇和乙酸在浓硫酸作用下加热制备乙酸乙酯,反应方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,为了除去乙酸乙酯中的乙醇和乙酸,用碳酸钠溶液吸收,乙酸乙酯与水不互溶,用分液漏斗分离,
故答案为:CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;碳酸钠溶液;分液.
点评 本题考查了有机物的制备实验,侧重于实验仪器、实验操作、产率的计算的考查,题目难度中等,考查了学生的实验探究能力,知道各个仪器作用及实验操作方法.


科目:高中化学 来源: 题型:选择题
 我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
我国支持“人文奥运”的一个重要体现是坚决反对运动员服用兴奋剂.某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )| A. | 该物质属于芳香族化合物 | |
| B. | 该有机物的分子式为C15H18O3 | |
| C. | 遇FeCl3溶液呈紫色,因为该物质与苯酚属于同系物 | |
| D. | 1mol该化合物最多可与含3molBr2的溴水发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K与F | B. | Na与Cl | C. | Al与S | D. | Mg与Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 那浮在试管中的液面上 | B. | 钠沉入试管底部 | ||
| C. | 钠燃烧起来 | D. | 钠处于煤油和水的交界处 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
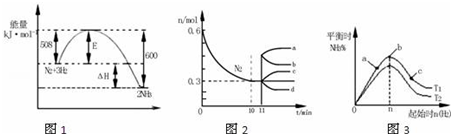
| A. | 由图1可知2NH3(g)?N2(g)+3H2(g)△H=-92kJ•mol-1 | |
| B. | 图2中0~10min内该反应的平均速率v(H2)=0.045mol•L-1•min-1,从11min起其它条件不变,压缩容器的体积为1L,则n(N2)的变化曲线为d | |
| C. | 图3中a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是b点 | |
| D. | 图3中T1和T2表示温度,对应温度下的平衡常数为K1、K2,则:T1>T2,K1>K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性 | B. | 最高价氧化物对应水化物的酸性 | ||
| C. | 单质与氢气反应的难易 | D. | 单质与氢气反应放出热量的多少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com