
| A. | 葡萄糖 | B. | 甲酸乙酯 | C. | 丁醛 | D. | 甲醛 |
分析 设有机物为X,如为一元醛,生成银的转化关系为X~2Ag,如为二元醛,即甲醛,反应的关系式为HCHO~4Ag,根据醛和银之间的关系式计算一份该醛的物质的量,
再结合消耗氧气的量计算该题.
解答 解:生成10.8g的银,可知n(Ag)=$\frac{10.8g}{108g/mol}$=0.1mol,醛的物质的量为:0.05mol,氧气的物质的量为$\frac{6.72L}{22.4L/mol}$=0.3mol,则1mol醛消耗6mol氧气,
A.葡萄糖燃烧关系式为:C6H12O6~6O2,1mol葡萄糖消耗6mol氧气,故A正确;
B.甲酸一酯燃烧关系式为:C3H6O~4O2,1mol甲酸丙酯消耗4mol氧气,故B错误;
C.丁醛燃烧关系式为:C4H8O~5.5O2,故C错误;
D.甲醛燃烧的关系式为:CH2O~O2,1mol甲醛完全燃烧消耗1mol氧气,故D错误;
故选A.
点评 本题考查了银镜反应和有机物燃烧的有关计算,题目难度中等,试题贴近高考,综合性强,该题的关键是明确反应的原理,然后根据有关的方程式并结合题意灵活分析、讨论和判断即可.


科目:高中化学 来源: 题型:选择题
| A. | H2O2、Na2O2都属于过氧化物,都存在共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.12升 | B. | 2,24升 | C. | 2.94升 | D. | 5.88升 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱性溶液:Cu2+、Al3+、NO3-、SO42- | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,c(H+)/c(OH一)=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 8g H2O在标准状况下的体积是22.4L | |
| C. | 2.4g金属镁变为镁离子时失去的电子数为NA | |
| D. | 17g氨气所含电子数目为8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2 NH4Cl Fe2(SO4)3 NaNO3 | |
| B. | (NH4)2SO4 CuSO4 Na2CO3 FeCl3 | |
| C. | Cu(NO3)2 NH4 NO3 FeCl3 H2S | |
| D. | Ba Cl2 Cu(NO3)2 (NH4)2SO4 Fe (NO3)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
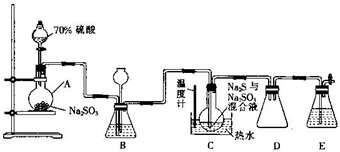 Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.
Na2S2O3•5H2O俗称:“海波”,是常用的定影剂和还原剂,它是无色晶体,易溶于水,不溶于乙醇,遇酸易分解:S2O32-+2H+=S↓+SO2↑+H2O,在20℃和70℃时的溶解度分别为60.0g和212.0g,Na2S2O3•5H2O在40~50℃时会熔化,48℃时会分解,工业上常利用含硫废水生产Na2S2O3•5H2O,实验室可用如图所示的装置(略去部分夹持仪器)模拟生成过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H、D、T互为同分异构体 | B. | 次氯酸的结构式为 H-Cl-O | ||
| C. | NH4Cl的电子式 为: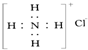 | D. | S2-的结构示意图为: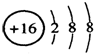 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com