
 化学反应原理在生活和生产中有着广泛的应用.利用“化学蒸气转移法”制备TaS2晶
化学反应原理在生活和生产中有着广泛的应用.利用“化学蒸气转移法”制备TaS2晶| △c |
| △t |
| 4.9 |
| 245 |
| ||
| 2 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在蓝色的淀粉溶液中通入足量SO2后成无色溶液:I2+SO2+2H2O=2I-+SO42-+4H+ |
| B、饱和Na2CO3溶液中通入CO2足量:2Na++CO32-+CO2+H2O=2NaHCO3↓ |
| C、钠投入CuSO4溶液中:2Na+Cu2++2H2O=2Na++Cu(OH)2↓+H2↑ |
| D、向酸性KMnO4溶液中加入H2O2:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
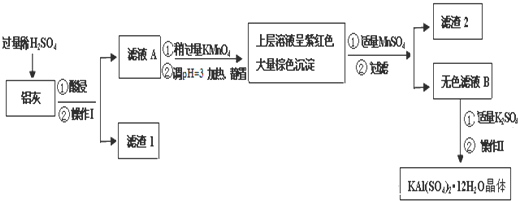
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管出口部分开始有气泡,滴定后气泡消失 |
| B、锥形瓶用蒸馏水冲洗后随即使用 |
| C、当看到锥形瓶中溶液的颜色发生变化后随即停止了滴定 |
| D、滴定管在用蒸馏水洗净后,即装入标准的酸溶液进行滴定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 化合物 | HCl | NaOH | Cu2(OH)2SO4 | FeSO4*7H2O |
| 氧化物 | H2O | Na2O | CO | Fe3O4 |
| 电解质 | 浓盐酸 | 纯碱晶体 | 胆矾晶体 | 铁 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Mg2+、Cl-、ClO- |
| B、NH3?H2O、SO32-、K+、Na+ |
| C、Fe2+、Na+、K+、NO3- |
| D、K+、Ca2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:
A、B、C、D、E、F是原子序数依次递增的前四周期元素.其中C与E同主族,且E的原子序数是C的两倍;A分别与B和C均可形成10电子分子;B与C的最外层电子数之比2:3;F原子的最外层电子数与A相同,其余各层均充满;常见化合物D2C2与水反应生成C的单质,其溶液可使酚酞试液先变红后褪色.据此回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com