
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
I.岩脑砂的制备
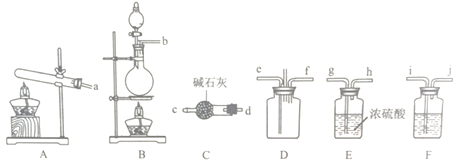
(1)该实验中用浓盐酸与二氧化锰反应制取所需氯气,写出该反应的化学反应方程式_____,装置F中的试剂是___________(填试剂名称)。
(2)为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:a→____→ef←___(用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化按固体会堵塞导管,之二为:___________。
(4)证明氨气和氯气反应有岩脑砂生成,需要的检验试剂(试纸)中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要______。热的浓氯化铵溶液可以清洗溶解铁器表面锈迹,写出相关反应的离子方程式_________________。
II.岩脑砂中元素的测定
准确称取ag岩脑砂,与足量的氧化铜混合加热(2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
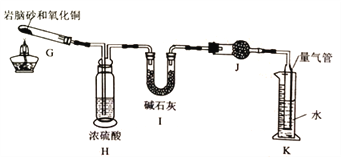
(5)设置装置H的目的是______________。
(6)若装置I增重bg,利用装置K洲得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=_____(用含b、V的代数式表示,不必化简)。若测量体积时气体温度高于常温(其他操作均正确且忽略气体摩尔体积的改变),则m(N)比正常值______(填“偏高”、“偏低”或“无影响”)。
【答案】 MnO2+4HCl![]() MnCl2+Cl2↑+2H2O 饱和食盐水 →dc hg←ji←b 无尾气处理装置 AgNO3溶液、红色石蕊试纸(其他合理答案即可) 6NH4++Fe2O3
MnCl2+Cl2↑+2H2O 饱和食盐水 →dc hg←ji←b 无尾气处理装置 AgNO3溶液、红色石蕊试纸(其他合理答案即可) 6NH4++Fe2O3![]() 2Fe3++6NH3↑+3H2O 吸收混合气体中的水蒸气,防止对测定氯化氢的质量产生影响 (28V/24.5):(35.5b/36.5) 偏高
2Fe3++6NH3↑+3H2O 吸收混合气体中的水蒸气,防止对测定氯化氢的质量产生影响 (28V/24.5):(35.5b/36.5) 偏高
【解析】(1)该实验中用浓盐酸与二氧化锰反应制取氯气,同时生成氯化锰和水,反应的化学反应方程式为MnO2+4HCl![]() MnCl2+Cl2↑+2H2O,装置F是用于除去氯气中的氯化氢,所装的试剂是饱和食盐水;(2)为了使氨气和氯气在D中充分混合,左边A装置利用氯化铵和氢氧化钙加热制取氨气,利用装置C进行干燥后进入D混合,氨气密度比空气小由长导管进从而逆向混合;右边由装置B利用二氧化锰和浓盐酸加热反应制取氯气,再经装置F除去氯化氢,再经装置E干燥后进入装置D混合;故装置的合理连接顺序为:a→dc→ef←hg←ji←b ;(3)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化按固体会堵塞导管,之二为:无尾气处理装置,氨气与氯气直接排放到空气中会造成污染;(4)检验岩脑砂(主要成分为NH4Cl)可利用强碱加热产生能使湿润红色石蕊试纸变蓝检验铵根离子,利用硝酸和硝酸银检验氯离子,故试剂(试纸)中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要AgNO3溶液、红色石蕊试纸;热的浓氯化铵溶液水解使溶液呈酸性,可以清洗溶解铁器表面锈迹,反应的离子方程式为6NH4++Fe2O3
MnCl2+Cl2↑+2H2O,装置F是用于除去氯气中的氯化氢,所装的试剂是饱和食盐水;(2)为了使氨气和氯气在D中充分混合,左边A装置利用氯化铵和氢氧化钙加热制取氨气,利用装置C进行干燥后进入D混合,氨气密度比空气小由长导管进从而逆向混合;右边由装置B利用二氧化锰和浓盐酸加热反应制取氯气,再经装置F除去氯化氢,再经装置E干燥后进入装置D混合;故装置的合理连接顺序为:a→dc→ef←hg←ji←b ;(3)装置D处有两个明显的不足之处,其中之一为:导管太细,生成的氯化按固体会堵塞导管,之二为:无尾气处理装置,氨气与氯气直接排放到空气中会造成污染;(4)检验岩脑砂(主要成分为NH4Cl)可利用强碱加热产生能使湿润红色石蕊试纸变蓝检验铵根离子,利用硝酸和硝酸银检验氯离子,故试剂(试纸)中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要AgNO3溶液、红色石蕊试纸;热的浓氯化铵溶液水解使溶液呈酸性,可以清洗溶解铁器表面锈迹,反应的离子方程式为6NH4++Fe2O3![]() 2Fe3++6NH3↑+3H2O;(5)设置装置H的目的是吸收混合气体中的水蒸气,防止对测定氯化氢的质量产生影响;(6)若装置I增重bg,则产物的氯化氢的物质的量为
2Fe3++6NH3↑+3H2O;(5)设置装置H的目的是吸收混合气体中的水蒸气,防止对测定氯化氢的质量产生影响;(6)若装置I增重bg,则产物的氯化氢的物质的量为![]() ,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则氮气的物质的量为
,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则氮气的物质的量为![]() ,则岩脑砂中m(N):m(Cl)=
,则岩脑砂中m(N):m(Cl)=![]() ;若测量体积时气体温度高于常温,氮气体积偏大,则m(N)比正常值偏高。
;若测量体积时气体温度高于常温,氮气体积偏大,则m(N)比正常值偏高。


科目:高中化学 来源: 题型:
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
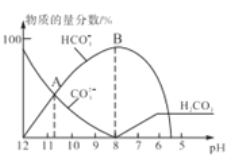
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物X、Y、Z的分子式均为C7H8,结构简式如图。下列说法正确的是
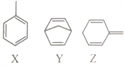
A. X、Y、Z分子中碳原子均能处在同一平面上
B. X、Y、Z三种有机物均能使酸性高锰酸钾溶液褪色
C. 1molX与Z的混合物中含有3mol碳碳双键
D. Y的一氯代物有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中正确的是( )
A.Al2(SO4)3=2Al3++3SO42﹣
B.Na2SO4=Na++SO42﹣
C.Ca(NO3)2=Ca2++2(NO3)2﹣
D.Ba(OH)2=Ba2++OH2﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下图中序号①~③仪器的名称:

①_________;② _________;③__________ ;
仪器①~④中,使用时必须检查是否漏水的有 _______.(填仪器序号)
(2)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.

现用该浓硫酸配制480mL1molL-1的稀硫酸.请回答下列问题:
a. 该硫酸的物质的量浓度为__________molL-1
b.经计算,配制480mL1molL-1的稀硫酸需要用量筒量取上述浓硫酸的体积为_______mL;
c.配制过程中下列各项操作会导致所配稀硫酸浓度偏小的是_____(双选)
A.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水
B.所选用的烧杯、玻璃棒未洗涤
C.定容时,俯视容量瓶刻度线
D.摇匀后静置发现液面低于刻度线,继续滴加蒸馏水至刻度处.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Ba2+ Mg2+ Ag+三种阳离子,现用适量的NaOH溶液、稀盐酸和Na2SO4溶液将这三种离子逐一沉淀分离,其流程如图所示:
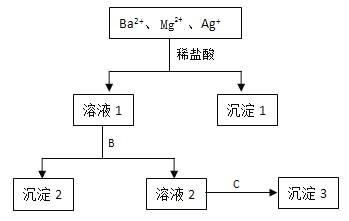
(1)沉淀1的化学式为 ,生成该沉淀的离子方程式为 。
(2)若试剂B为Na2SO4溶液,则沉淀2化学式为 。
(3)若试剂B为NaOH溶液,则生成沉淀2的离子方程式为 。
(4)如果原溶液中Ba2+ Mg2+ Ag+的浓度均为0.1 mol·L-1,且溶液中含有的阴离子只有NO3-,则溶液中NO3- 浓度为 mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各溶液中一定能大量共存的离子组是( )
A. 使酚酞溶液呈红色的溶液中:Mg2+、Cu2+、SO![]() 、K+
、K+
B. 使pH试纸呈红色的溶液中:Fe2+、K+、NO![]() 、Cl-
、Cl-
C. c(H+)=10-14 mol·L-1溶液中:Na+、AlO![]() 、S2-、SO
、S2-、SO![]()
D. 水电离出的c(H+)为10-12mol·L-1的溶液中:K+、Na+、CO![]() 、Ca2+
、Ca2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com