
| A. | 物质的质量之比为9:1 | B. | 原子数之比为1:1 | ||
| C. | 分子数之比为1:1 | D. | 电子数之比为5:1 |
分析 A.根据m=nM判断;
B.每个H2O分子含有3个原子,每个H2分子含有2个原子;
C.根据N=nNA判断;
D.每个H2O分子含有10个电子,每个H2分子含有2个电子.
解答 解:A.根据m=nM,相同物质的量的H2O和H2,物质的质量之比为n×18g/mol:n×2g/mol=9:1,故A正确;
B.每个H2O分子含有3个原子,每个H2分子含有2个原子,物质的量相同的H2O和H2含有原子数目之比=3:2,故B错误;
C.根据N=nNA可知,物质的量相同的H2O和H2具有相同的分子数目,故C正确;
D.每个H2O分子含有10个电子,每个H2分子含有2个电子,物质的量相同的H2O和H2含有电子数之比为5:1,故D正确;
故选B.
点评 本题考查微粒数目的计算,题目难度不大,理解化学式的意义是解题关键.


科目:高中化学 来源: 题型:选择题
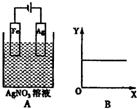
| A. | c (Ag+) | B. | 溶液的pH | C. | Ag棒的质量 | D. | c(NO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
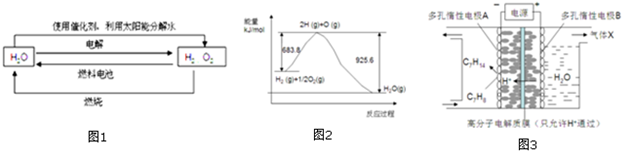
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
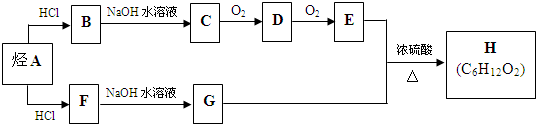
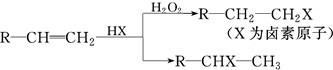
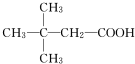 .(用结构简式表示)
.(用结构简式表示) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
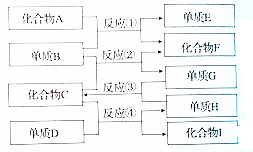
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10%的H2SO4溶液 | B. | NaCl | ||
| C. | 碱石灰(固体,含NaOH,CaO) | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 7:8 | D. | 8:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
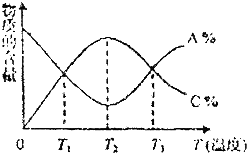
| A. | 该反应在T1、T3温度时达到过化学平衡 | |
| B. | 该反应的正反应是吸热反应 | |
| C. | 该反应在T2温度时达到过化学平衡 | |
| D. | 升高温度,平衡会向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
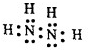
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com