
| 药名 | 胃舒平 | 达喜 |
| 有效成分的化学式 | Al(OH)3 | Al2Mg6(OH)16CO3•4H2O |
| 相对分子质量 | 78 | 530 |
| 每片含有效成份的药量 | 0.245g | 0.5g |
分析 (1)根据n=$\frac{V}{{V}_{m}}$=$\frac{m}{M}$结合物质的分子构成计算;
(2)根据铁离子的质量求得铁离子的物质的量,根据化学式计算硫酸根离子的物质的量,然后除以溶液的体积即得物质的量浓度;
(3)根据该氧化物的化学式可知n(NOx)=n(N)=0.2mol,然后根据M=$\frac{m}{n}$计算出其摩尔质量;根据所得摩尔质量可知其相对分子质量,然后列式计算出x;
(4)根据n=$\frac{V}{{V}_{m}}$计算,在标准状况下Vm=22.4L/mol;
(5)计算5片Al2Mg6(OH)16CO3•4H2O可以中和氢离子物质的量,再根据Al(OH)3+3HCl=AlCl3+3H2O计算氢氧化铝物质的量,进而计算氢氧化铝的质量,据此计算解答.
解答 解:(1)标准状况下4.48L CO2的物质的量为$\frac{4.48L}{22.4L/mol}$=0.2mol,含有O原子的物质的量为0.4mol,所含氧原子数目相同的水的物质的量为0.4mol,则水的质量为0.4mol×18g/mol=7.2g;
故答案为:7.2;
(2)V L Fe2(SO4)3溶液中,含有Fe3+ m g,
则n(Fe3+)=$\frac{mg}{56g/moL}$=$\frac{m}{56}$,
根据化学式可得SO42-的物质的量为n(SO42-)=$\frac{3}{2}$×n(Fe3+)=$\frac{3}{2}$×$\frac{m}{56}$mol,
所以SO42-的物质的量浓度为c(SO42-)=$\frac{n}{V}$=$\frac{\frac{3}{2}×\frac{m}{56}mol}{VL}$=$\frac{3m}{112V}$mol/L,
故答案为:$\frac{3m}{112V}$mol/L;
(3)9.2g氮的氧化物NOx中含氮原子0.2mol,则n(NOx)=n(N)=0.2mol,NOx的摩尔质量为:M(NOx)=$\frac{9.2g}{0.2mol}$=46g/mol,
即NOx的相对分子质量为46,则14+16x=46,解得:x=2;
故答案为:2;
(4)0.4mol某气体的体积为9.8L,n=$\frac{V}{{V}_{m}}$=$\frac{9.8L}{0.4mol}$=24.5,在标准状况下Vm=22.4L/mol,所以气体所处的条件不是标准状况;
故答案为:24.5L/mol;不是;
(5)设5片Al2Mg6(OH)16CO3•4H2O可以中和氢离子物质的量为X.
Al2Mg6(OH)16CO3•4H2O~18HCl
602 18
0.5g×5 X
$\frac{602}{0.5×5}$=$\frac{18}{X}$
解得X=0.075mol,
Al(OH)3+3HCl=AlCl3+3H2O
1 3
x 0.075mol
x=$\frac{0.075mol×1}{3}$=0.025mol
故氢氧化铝质量=0.025mol×78g/mol,
5片达喜片相当于胃舒平的片数为:$\frac{0.025mol×78g/mol}{0.245g}$=8,故含铝的物质的量较多的是10片胃舒平;
故答案为:10片胃舒平.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量的有关计算公式即可解答,注意把握气体摩尔体积的适用条件,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:实验题
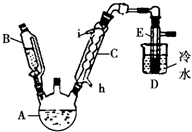 如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.
如图所示是实验室用浓硫酸、溴化钠(先生成HBr)与乙醇反应来制备溴乙烷(C2H5Br)的装置,反应需要加热,图中省去了夹持与加热装置,有关物质的性质如下表.| 乙醇 | 溴乙烷 | 溴 | |
| 通常情况下状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度/g•cm-3 | 0.79 | 1.44 | 3.1 |
| 沸点/℃ | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
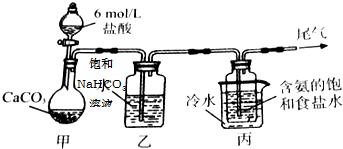
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 物质的性质 | 实际应用 |
| A | 二氧化锰具有强氧化性 | 用作H2O2分解的氧化剂 |
| B | 液氨汽化时要吸收大量的热 | 用作制冷剂 |
| C | Al2O3熔点高 | 用作耐高温材料 |
| D | 肥皂水显碱性 | 用作蚊虫叮咬处的清洗剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH | |
| D. | 镀层破损后,镀锌铁板比镀锡铁板更易腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑦ | B. | ①②③⑤⑥⑦ | C. | ①②③④ | D. | ②③⑦⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
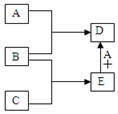 已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如图所示(反应条件和部分产物已省略).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验内容 | 实验现象 | 离子方程式 | 实验结论 |
| ① | 在FeCl2溶液中滴入适量氯水 | 溶液由浅绿色变为黄色 | 2Fe2++Cl2=2Fe3++2Cl- | Fe2+具有还原性 |
| ② | 在FeCl3溶液中加入足量铁粉 | 溶液由黄色变为浅绿色 | Fe+2Fe3+=3Fe2+ | Fe3+具有氧化性 |
| ③ | 在FeCl3溶液中滴入适量KI溶液和淀粉溶液 | 溶液最终变为蓝色 | 2Fe3++2I-═2Fe2++I2 | Fe3+具有氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com