
| A. | Cl2与H2O反应:Cl2+H2O═2H++ClO-+Cl- | |
| B. | 往FeCl3溶液中加入Cu粉:Fe3++Cu═Fe2++Cu2+ | |
| C. | 向AlCl3溶液中滴加氨水至过量:Al3++3OH-═Al(OH)3↓ | |
| D. | 将铜片投入浓硝酸中:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O |
分析 A.次氯酸为弱酸,离子方程式中次氯酸不能拆开;
B.离子方程式两边正电荷不相等,违反了电荷守恒;
C.氨水为弱碱,离子方程式中一水合氨不能拆开;
D.铜与浓硝酸反应生成硝酸铜、二氧化氮气体和水.
解答 解:A.Cl2与H2O反应生成氯化氢和次氯酸,正确的离子方程式为:Cl2+H2O═H++HClO+Cl-,故A错误;
B.往FeCl3溶液中加入Cu粉,反应生成硫化铜和氯化亚铁,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,故B错误;
C.向AlCl3溶液中滴加氨水至过量,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故C错误;
D.铜片投入浓硝酸中生成二氧化氮气体,反应的离子方程式为:2NO3-+Cu+4H+═Cu2++2NO2↑+2H2O,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | B | ||||||
| 2 | D | E | F | G | ||||
| 3 | C | H | I |
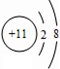 ,I的原子结构示意图
,I的原子结构示意图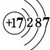 .
. ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
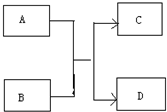 运用有关知识,回答下列问题.
运用有关知识,回答下列问题.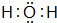 ,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.
,实验室中检验C的试剂及现象是湿润的红色石蕊试纸变蓝色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是按照元素相对原子质量大小排列而成的 | |
| B. | 元素周期表有7个横行,也是7个周期;有18个纵行,即18个族 | |
| C. | 凡是位于元素周期表中同一周期的元素,都是按从左到右的顺序原子最外层电子数由1递增到8 | |
| D. | 凡是位于元素周期表中同一主族的元素,都是按从上到下的顺序电子层数逐渐增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
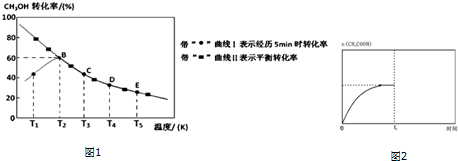
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
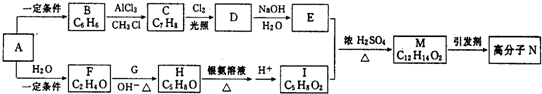
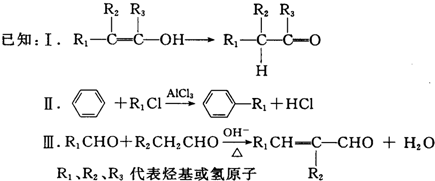
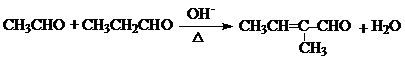 .
.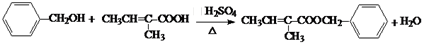 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所得溶液中C(Fe2+):C(Fe3+)=1:1 | B. | 所得溶液中C(NO3-)=2.75mol/L | ||
| C. | 反应后生成NO的体积为28 L | D. | 所得溶液中溶质只有FeSO4和K2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
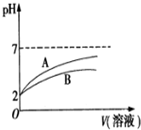 2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.
2015年8月12日天津港发生了危化品特大爆炸事故,爆炸仓库存有大量氰化钠(NaCN)、硝酸铵、四氯化钛等物品.| 物质 | Cl2 | TiCl4 | O2 |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com