
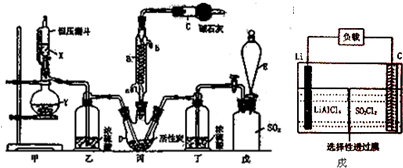
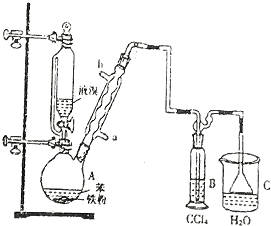
分析 磺酰氯(SO2Cl2)的制备:SO2+Cl2?SO2C12,氯气和SO2在木炭作催化剂的作用下合成SO2C12,因SO2Cl2是一种无色液体,极易水解生成硫酸和盐酸,遇潮湿空气会产生白雾,因此要保证参加反应的氯气和SO2是干燥的,同时要防止空气中的水汽进入三颈瓶中,为了减小生成物的损失需要使用冷凝管冷凝回流,同时要利用碱石灰吸收SO2和氯气的尾气防污染,反应后的液体混合物可利用蒸馏进行分离,甲装置:浓盐酸和高锰酸钾固体制备氯气,乙装置:干燥氯气,丙装置:制备磺酰氯,同时防止外界空气中的水蒸气进入三颈烧瓶,丁装置:干燥装置,防止SO2Cl2的水解,戊装置:贮存二氧化硫气体,据此分析作答.
(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,根据化合价规则计算S元素的化合价;
(2)结合常见的仪器,可命名仪器D;因SO2Cl2易水解,应防止水进入反应容器中;
(3)戊是储存SO2的装置,可以通过E中滴加的溶液排出SO2气体,因此此溶液不能溶解SO2;装置乙和丁的装置均为干燥装置,防止SO2Cl2的水解;
(4)相互混溶的液体混合物可以根据沸点差异进行分离;
(5)装置甲是制备Cl2的,催化剂可以改变反应速率,蒸馏操作应在蒸馏烧瓶中进行,冷凝管仅是冷却蒸汽的;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应.
解答 解:(1)化合物SO2Cl2中O元素为-2价、Cl元素为-1价,令S元素化合价为x,根据化合价规则x+2×(-2)-1=0,故x=6,即S元素的化合价为+6,
故答案为:+6;
(2)仪器D是三颈瓶,C中碱石灰除吸收含有氯气和二氧化硫的尾气,还可以防止水进入三颈瓶中,避免SO2Cl2水解,故答案为:三颈瓶;防止空气中的水进入三颈瓶;
(3)通过E中的溶液排出戊中SO2,因此可选择饱和亚硫酸氢钠溶液;若没有乙和丁的干燥装置,会有水进入三颈瓶中,发生SO2Cl2的水解,反应方程式为SO2Cl2+2H2O=2HCl+H2SO4,
故答案为:饱和亚硫酸氢钠溶液;SO2Cl2+2H2O=2HCl+H2SO4;
(4)可利用蒸馏操作分离相互混溶的液体混合物,故答案为:蒸馏;
(5)a、铜片和浓硫酸在加热条件下只能生成SO2,而甲装置是制Cl2的,应该是浓盐酸和高锰酸钾固体,故错误;
b、可选择活性炭催化SO2和Cl2的反应,故b正确;
c、冷凝管B只起冷凝作用,蒸馏操作应在蒸馏烧瓶内进行,故c错误;
故选b;
(6)正极是SO2Cl2中+6价的硫得电子发生还原反应,所以电极反应式为:SO2Cl2+2e-=2Cl-+SO2↑,
故答案为:SO2Cl2+2e-=2Cl-+SO2↑.
点评 本题考查化学制备实验、对装置与操作的分析评价、对信息获取及应用和电极反应式的书写等,关键是明确原理,需要学生具备扎实的基础与灵活运用的能力,题目难度中等.


 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案科目:高中化学 来源: 题型:选择题
| A. | NaBiO3 | B. | Na4XeO6 | C. | K2S2O8 | D. | PbO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
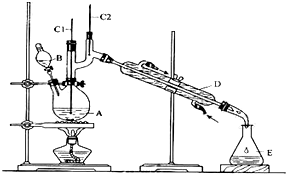
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
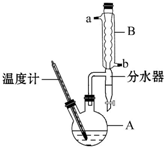 1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:
1-溴丙烷常用作有机反应的溶剂.实验室制备1-溴丙烷(CH3CH2CH2Br)的反应和主要实验装置如图:| 相对分 子质量 | 密度 /g•mL-1 | 沸点/℃ | 水中 溶解性 | |
| 正丙醇 | 60 | 0.896 | 97.1 | 溶 |
| 正丙醚 | 102 | 0.74 | 90 | 几乎不溶 |
| 1-溴丙烷 | 123 | 1.36 | 71 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
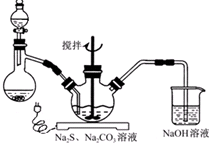 NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
NaCN为剧毒无机物.某化学兴趣小组查阅资料得知,实验室里的氰化钠溶液可使用硫代硫酸钠溶液进行统一解毒销毁,他们开展了以下三个实验,根据要求回答问题:
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
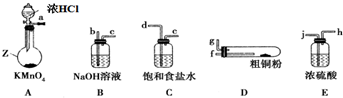

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
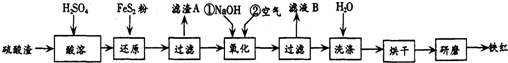
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO的生成速率与CO2的生成速率相等 | |
| B. | 气体的密度不再变化 | |
| C. | CO的质量不变 | |
| D. | 体系的压强不再发生变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com