
����Ŀ���ϳɰ���ҵ������������Ȼ����ˮ������Ӧ�Ʊ�������Ҫ��ӦΪ��
CH4+ 2H2O![]() CO2+4H2����֪��
CO2+4H2����֪��
CH4��g��+2O2��g����CO2��g��+2H2O��l�� ��H=-890kJ/mol
2H2��g��+O2��g����2H2O��l�� ��H=-571.6kJ/mol
H2O��g����H2O��l�� ��H=-44kJ/mol
��1��д������Ȼ����ˮ������Ӧ�Ʊ�H2���Ȼ�ѧ����ʽ��____________��
��2��ij�¶��£�10L�ܱ������г���2mol CH4��3mol H2O��g��������CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g����Ӧ����һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4����
CO2��g��+4H2��g����Ӧ����һ��ʱ�䷴Ӧ��ƽ�⣬ƽ��ʱ������ѹǿ����ʼʱ��1.4����
����ƽ��ʱ��CH4��ת����Ϊ__________��H2��Ũ��Ϊ_________����Ӧ���ų�����������_______kJ��
������ƽ����ϵ���¶�,��������ƽ����Է�������___________,�ܶ�_________�����������������С����������������
�����ﵽƽ��ʱ,�������,������ѹǿ����,ƽ�⽫___________�������������������������������ƶ���
�������ֺ��£�������ѹ��Ϊ5L���������Ծ�Ϊ��̬����ƽ�⽫________�������������������������������ƶ����ﵽ��ƽ���,������H2Ũ�ȷ�ΧΪ__________��
���𰸡�CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g�� ��H=+165.2kJ/mol 50% 0.4mol/L 165.2 ��С ���� ���� ���� 0.4mol/L��c��H2����0.8mol/L
CO2��g��+4H2��g�� ��H=+165.2kJ/mol 50% 0.4mol/L 165.2 ��С ���� ���� ���� 0.4mol/L��c��H2����0.8mol/L
��������
��1����֪����CH4��g��+2O2��g����CO2��g��+2H2O��l�� ��H��-890kJ/mol����2H2��g��+O2��g����2H2O��l����H��-571.6kJ/mol����H2O��g����H2O��l�� ��H��-44kJ/mol������ݸ�˹���ɿ�֪�٣�����2���ۼ��õ���Ȼ����ˮ������Ӧ�Ʊ�H2���Ȼ�ѧ����ʽCH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g�� ��H��+165.2kJ/mol��
CO2��g��+4H2��g�� ��H��+165.2kJ/mol��
��2�� CH4��g��+ 2H2O��g��![]() CO2��g��+4H2��g��
CO2��g��+4H2��g��
��ʼ����mol��2 3 0 0
ת������mol��x 2x x 4x
ƽ������mol��2-x 3��2x x 4x
��2-x+3��2x+x+4x��5��1.4�����x��1��
��ƽ��ʱ��CH4��ת����Ϊ![]() ��100%=50%��H2��Ũ��Ϊ4mol��10L��0.4mol/L����Ӧ����������1mol��165.2kJ/mol��165.2kJ��
��100%=50%��H2��Ũ��Ϊ4mol��10L��0.4mol/L����Ӧ����������1mol��165.2kJ/mol��165.2kJ��
������Ӧ�����ȷ�Ӧ��������ϵ���¶�ƽ��������Ӧ������У���������ʵ������ӣ����������ƽ����Է���������С���ݻ����䣬�ܶȲ��䣻
�۵��ﵽƽ��ʱ���������������ѹǿ���䣬���ݻ������൱�ڼ�Сѹǿ������ƽ�⽫�����ƶ���
�ܱ��ֺ��£�������ѹ��Ϊ5L���������Ծ�Ϊ��̬��������ѹǿ��ƽ�⽫�����ƶ���������������ԭ����֪�ﵽ��ƽ���������H2Ũ�ȷ�ΧΪ0.4mol/L��c��H2����0.8mol/L��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M�Ǿۺ��コ����Ϳ�ϵȵĵ��壬��һ���ϳ�·�����£������Լ�����Ӧ����ʡ�ԣ���
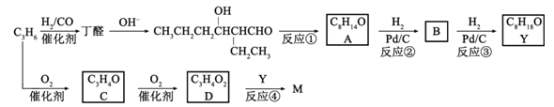
���������գ�
��1����Ӧ���ķ�Ӧ������____________����Ӧ���ķ�Ӧ������_____________��
��2�������������⣬��A�õ�![]() �����Լ�Ϊ___________��
�����Լ�Ϊ___________��
��3����֪B�ܷ���������Ӧ���ɷ�Ӧ������Ӧ��˵�����ڸ������£�_______________��
��4��д���ṹ��ʽ��C________________ M________________
��5��D��1-������Ӧ�IJ���������ϩ���ۿ���߾ۺ������ܣ�д���ù�����Ľṹ��ʽ��_____________
��6��д��һ���������������Ķ�ȩ��ͬ���칹��Ľṹ��ʽ��____________
�������ʻ�������3�ֲ�ͬ��ѧ��������ԭ��
��֪��˫��̼�������ǻ��Ľṹ���ȶ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ����ʾʵ��װ�õ�K�պϣ������ж���ȷ���ǣ�������
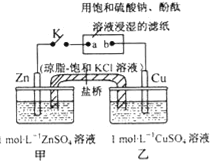
A.Zn���Ϸ�����ԭ��Ӧ
B.������Zn��a��b��Cu·������
C.Ƭ�̺��ҳ���c��Cu2+����С��c��SO42�����������䣬��Һ���ٱ��ֵ�����
D.Ƭ�̺�ɹ۲쵽��ֽa����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���мס���������ȫ��ͬ��װ�ã��ֱ������ǵIJ����װ��1.06g Na2CO3��0.84g NaHCO3���Թ��и���10mL��ͬŨ�ȵ����ᣨ��ͼ����ͬʱ����������е�����ȫ��������Ե��Թ��У�����������ȷ����
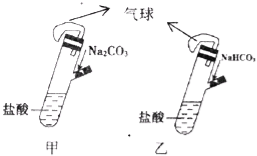
A. ��װ�õ������������ʴ�
B. �����������������ͬ����һ����c��HCl����2 mol/L
C. �����������������ͬ����һ����c��HCl����1 mol/L
D. ��������Һ��Na+��Cl�������ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ƿ�չ�߿Ƽ���ҵ���������˼������ɻ�ȱ��ԭ�ϡ�H2TeO3��һ�ֱȲ����������Ķ�Ԫ�ᣬ��ҵ�ϳ���ͭ������[��Ҫ�ɷ����ڻ���ͭ(Cu2Te)����������Ag��Au]�����ڣ��乤���������£�
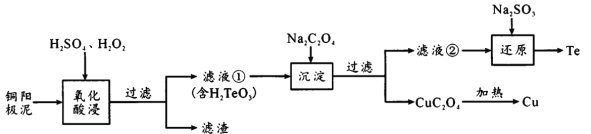
��֪��CuC2O4��KspΪ2.2��10-8������Ũ��С��1��10-5mol/Lʱ����������ȫ������
(1)Cu2Te��Te�Ļ��ϼ���___��
(2)�����ijɷ���___����Һ���к��е��������ʱ��������Ϊ____���������ʱ�¶ȹ���ʹ�ڵĽ����ʽ��ͣ�ԭ����_______��
(3)��ҪʹCu2+��ȫ������Ӧ����C2O42-��Ũ�Ȳ�����_____��
(4)��ԭ��Ӧ�����ӷ���ʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����2L�ܱ������ڣ�800��ʱ��Ӧ��2NO(g)+O2(g)![]() 2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
2NO2(g)��ϵ�У�n(NO)��ʱ��ı仯�����
ʱ��(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.01. | 0.008 | 0.007 | 0.007 | 0.007 |
��1����֪��K300����K350����д���÷�Ӧ��ƽ�ⳣ������ʽ��K=_________________�����ڸ÷�Ӧ������˵���У���ȷ����________��
A����H>0����S>0 B����H>0����S<0
C����H<0����S<0 D����H<0����S>0
��2����ͼ�б�ʾNO2�ı仯��������____________________����O2��ʾ��0-2s�ڸ÷�Ӧ��ƽ������v=_______________��
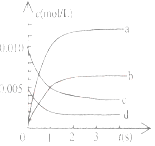
��3����˵���÷�Ӧ�Ѵﵽƽ��״̬����__________��
A��v(NO2)=2v(O2) B��������ѹǿ���ֲ���
C��v (NO)=2v��O2�� D���������ܶȱ��ֲ���
��4�����д�ʩ����ʹn(NO2)/n(NO)�������____��(����ĸ)
A�������¶� B���������
C�����ϳ���O2 D������He(g)��ʹ��ϵ��ѹǿ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼Ԫ�����γɶ��ֵ�������ʯ��ʯī�ȣ�24g ���ʯ�к���_______��̼̼������̼Ԫ��Ҳ���γɶ��ֻ�������γɻ�����ʱ�������ɻ�ѧ���Թ��ۼ�Ϊ����ԭ���� _______��
(1)��ҵ��þʱ����� MgCl2 ������� MgO ��ԭ���� _______��
(2)BeCl2 �۵�ϵͣ����������������л��ܼ����ɴ˿��Ʋ� BeCl2 ����Ϊ _______���壨������ͣ��������Ϊ_______���ӣ����������������Ǽ������������ӹ���Ϊ_______��BeCl2 �۵�_______��ѡ����������������������BeBr2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������X���ܺ���NaNO2��Na2SiO3��FeCl3��KAlO2�е�һ�ֻ������ʣ�ijͬѧ�Ըù������������ʵ�飺

�����ж���ȷ����
A.��Һ����һ������NaNO2��Na2SiO3�����ܺ���FeCl3��KAlO2
B.ԭ��������X��һ����KAlO2
C.�����ҡ����嶡һ���Ǵ�����
D.����Һ�Һ���Һ�����һ������ɫ�������ɣ������а�ɫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ���(H2C2O4)�׳Ʋ��ᣬ��ʵ���о��ͻ�ѧ��ҵ��Ӧ�ù㷺��
(1) �����£���� 0.1 mol��L1 H2C2O4��Һ��pH = 1.3��д������ĵ��뷽��ʽ_______��
(2)������Һ�и����ӵ����ʵ�����������ҺpH�仯��ϵ��ͼ��ʾ��
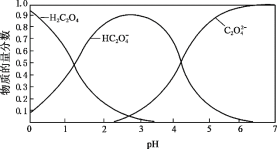
�� �������Һ�еμ�KOH��Һ��pH = 2.5ʱ��������Ҫ��Ӧ�����ӷ���ʽ��_______��
�� 0.1 mol��L1 KHC2O4��Һ�У���������Ũ�ȹ�ϵ��ȷ����_______(�����)��
a.c(K+) + c(H+) = c(HC2O4�C) + c(C2O42�C) + c(OH�C)
b.c(K+) > c(HC2O4�C) > c(C2O42�C) > c(H2C2O4)
c.c(K+) = c(HC2O4�C) + c(C2O42�C) + c(H2C2O4)
(3)��ҵ������������������ᷴӦ�Ʊ������������壬�����ӷ���ʽΪ��Fe2+ + H2C2O4 + xH2O FeC2O4��xH2O�� + 2H+
�� �Ʊ�ʱ�����Ӱ�ˮ�����FeC2O4��xH2O�IJ��ʣ��ӻ�ѧƽ���ƶ�ԭ���ǶȽ���ԭ��_____��
�� �ⶨ������������(FeC2O4��xH2O)��xֵ��ʵ�����£���ȡ0.5400 g����������������һ��Ũ�ȵ������У���KMnO4������Һ�ζ�������ζ��յ�ʱ������0.1000 mol��L��1��KMnO4������Һ18.00 mL����֪���ζ�����������̼Ԫ�ر�����ΪFe3+��CO2����Ԫ�ر���ԭΪMn2+��FeC2O4��xH2O��x = _______(FeC2O4��Ħ��������144 g��mol��1)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com