
【题目】有一无色透明溶液,欲确定是否含有下列离子:
Na+、Mg2+、Al3+、Fe2+、Ba2+、NO![]() 、SO
、SO![]() 、Cl-、SO32-、HCO
、Cl-、SO32-、HCO![]() ,取该溶液进行以下实验:
,取该溶液进行以下实验:
①取少量待测液,加入几滴石蕊试液,溶液呈红色。
②取少量待测液,浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色。
③取少量待测液,加入BaCl2溶液,有白色沉淀产生。
④取实验③中上层清液滴加AgNO3溶液,有白色沉淀产生,此沉淀不溶于稀硝酸。
⑤另取少量原溶液滴加NaOH溶液,有白色沉淀产生,当NaOH过量时,沉淀部分溶解。
(1)根据以上实验,溶液中肯定存在的离子是_________________;肯定不存在的离子是______________;尚不能确定的离子是_______________。
(2)写出②中有关反应的离子方程式:________________________________________。
(3)写出⑤中沉淀溶解的离子方程式:________________________________________。
(4)实验室检验Na+一般用焰色反应即可确定,此实验做之前要用______清洗铂丝。
【答案】Mg2+、Al3+、![]() 、
、![]() Fe2+、Ba2+、SO32-、
Fe2+、Ba2+、SO32-、![]() Na+、Cl- 3Cu+8H++2
Na+、Cl- 3Cu+8H++2![]() ===3Cu2++2NO↑+4H2O Al(OH)3+OH- ===
===3Cu2++2NO↑+4H2O Al(OH)3+OH- ===![]() +2H2O 稀盐酸
+2H2O 稀盐酸
【解析】
无色溶液中,有色离子不能存在,氢氧化铝是两性氢氧化物,能溶于强碱中,白色且不溶于硝酸的白色沉淀是氯化银或硫酸钡,在酸性环境下,能和氢离子反应的离子不能共存,根据离子反应的现象以及离子共存的知识加以分析。
因是无色溶液,Fe2+是浅绿色,所以不含Fe2+;
①由于滴加几滴石蕊试液,溶液呈红色,证明溶液显酸性,因此溶液中一定没有SO32-、HCO3-;②待测液浓缩后加入铜片和浓硫酸,加热,有无色气体产生,此无色气体遇空气变成红棕色,说明原溶液中一定含有NO3-;
③取少量待测液,加入BaCl2溶液,有白色沉淀产生,则原溶液中一定含有SO42-,故一定没有Ba2+;
④由于③的上层清液滴中加AgNO3溶液,有白色沉淀产生且不溶于稀硝酸,说明含有Cl-,但由于③中加入了BaCl2溶液,无法证明原溶液中是否存在Cl-;
⑤由于原溶液中加入NaOH溶液有白色沉淀产生,当NaOH过量时,沉淀部分溶解,则含有Al3+、Mg2+;
Na+在水溶液里无色,不会参与上述反应,所以无法判断原溶液中是否存在Na+;
(1)根据以上分析可知,溶液中一定存在的离子有Mg2+、Al3+、NO3-、SO42-;肯定不存在的离子是Fe2+、 Ba2+、SO32-、HCO3-;尚不能确定的离子是Na+、Cl-;
答案为:Mg2+、Al3+、NO3-、SO42-;Fe2+、 Ba2+、SO32-、HCO3-;Na+、Cl-;
(2) ②中原溶液加入铜片和浓硫酸并加热生成NO,离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
答案为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。
(3) ⑤中加NaOH溶液,生成的白色沉淀为Mg(OH)2和Al(OH)3,当NaOH过量时,部分溶解的是Al(OH)3,离子方程式为:Al(OH)3+OH- =AlO2-+2H2O;
答案为:Al(OH)3+OH- =AlO2-+2H2O。
(4)溶液里的钠离子是否存在一般用焰色反应来确定,钠离子的焰色反应为黄色,实验之前,为防止杂质的干扰,用稀盐酸先清洗铂丝;
答案为:稀盐酸。


科目:高中化学 来源: 题型:
【题目】下列关于蔗糖属于非还原型糖,而其水解产物具有还原性的实验方案的说法中,正确的是

A. 验证蔗糖属于非还原型糖的操作顺序:④③
B. 验证蔗糖属于非还原型糖的操作顺序:③⑤
C. 验证蔗糖水解产物具有还原性的操作顺序:①④⑤
D. 验证蔗糖水解产物具有还原性的操作顺序:①⑤②④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物J是合成药物格列卫的一种重要中间体,J的一种合成路线如下:

已知:①
②R-NH2 R-NH2
R-NH2
回答下列问题:
(1)B的名称为________。
(2)H→I和I→J的反应类型分别为________、________。
(3)G的结构简式为________。
(4)由E生成F的化学方程式为_______________________________________________。
(5)芳香化合物X是E的同分异构体,X能发生银镜反应,并能发生水解反应,其核磁共振氢谱有4组峰,峰面积之比为1∶4∶2∶1,写出符合条件的X的结构简式________________
(6)写出用甲苯为原料制备聚合物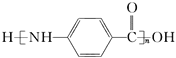 的合成路线:_______________
的合成路线:_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.H2(g)+I2(g) 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B.C(s)+H2O(g) H2(g)+CO(g),气体的总物质的量不再改变不能说明反应已达平衡
C.若压强不再随时间变化能说明反应2A(?)+B(g) 2C(?)已达平衡,则A、C不能同时是气体
D.1 mol N2和3 mol H2反应达到平衡时H2转化率为10%,放出的热量为Q1;在相同温度和压强下,当2 mol NH3分解为N2和H2的转化率为10%时,吸收的热量为Q2,Q2等于Q1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4溶液反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是( )
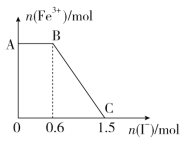
A.图中AB段的氧化剂为K2Cr2O7
B.与Fe2+反应的K2Cr2O7为0.25 mol
C.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
D.K2Cr2O7与KI反应的物质的量之比为1∶6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子
B.向100mL 1mol·L-1Fe(NO3)3溶液中滴加足量HI溶液,转移0.1NA个电子
C.4.6 g SO2和CO2的混合气体含有的电子数为2.3NA
D.120g NaHSO4固体中阳离子和阴离子的总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下能一步转化的组合有
序号 | X | Y | Z | W |
|
① | Cu | CuSO4 | Cu(OH)2 | CuO | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Al | AlCl3 | Al(OH)3 | Al2O3 | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③④C.①②④D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去)。已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀。
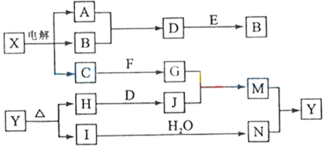
请回答下列问题:
(1)A在B中燃烧的现象是__________________________________________。
(2)D+E→B的反应中,被氧化与被还原的物质的物质的量比是_________________________。
(3)G+J→M的离子方程式是____________________________________。
(4)Y受热分解的化学方程式是______________________________________。
(5)检验硫酸铁溶液中是否存在Fe2+的试剂是 ____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com