
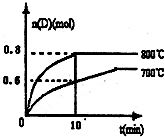
 ��1����֪��N2��g��+O2��g��=2NO��g����H=180.5kJ?mol-1
��1����֪��N2��g��+O2��g��=2NO��g����H=180.5kJ?mol-1| ��C |
| ��t |
| c(C)��c(D) |
| c(A)��c2(B) |
| ||
| 10min |
| v��(B) |
| v��(D) |
| 2 |
| 1 |
| c(C)��c(D) |
| c(A)��c2(B) |
| 0.4��0.4 |
| 0.4��0��42 |


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
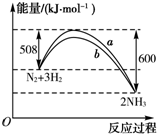
| A���÷�Ӧ���Ȼ�ѧ����ʽΪN2+3H2?2NH3��H=-92 kJ?mol-1 |
| B��a�����Ǽ������ʱ�������仯���� |
| C������������û�ѧ��Ӧ�ķ�Ӧ�ȸı� |
| D�������¶ȣ���Ӧ���ʼӿ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ӻ������ֻ�������Ӽ���û�й��ۼ� |
| B���κη�����һ�������ڻ�ѧ�� |
| C���ڹ��ۻ���������ڣ�һ�����������Ӽ� |
| D��ȫ���ɷǽ���Ԫ���γɵĻ������в����ܺ������Ӽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| A��Dһ���ǽ���Ԫ�أ�������Ա�Cǿ |
| B��C������������Ӧ��ˮ����һ����ǿ���� |
| C��B���⻯��һ���Ƿ��Ӿ��壬������һ��������� |
| D��E��ԭ������һ����A��5������ԭ�Ӱ뾶��A�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ʒ�������ϡ������ |
| B�����Ʒ�������ˮ�� |
| C�����Ʒ�������ͭ��Һ�� |
| D���������������ò���ЩС�ף��ٷ���ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A������������ | B������������ |
| C���������� | D�����ڵ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com