

分析 (1)已知:①C(s)+H2O(g)?CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)?CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
盖斯定律计算①-②得到反应③的热化学方程式,催化剂降低反应活化能,加快反应速率,不改变化学平衡;
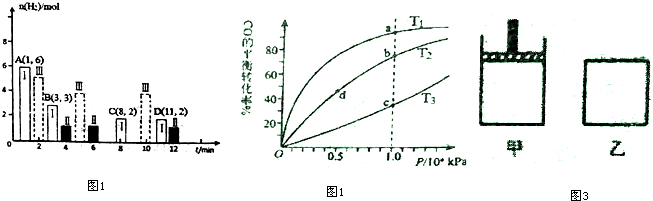
(2)①结合化学平衡三行计算列式计算,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示,N起始量为1.00mol/L为二氧化碳,平衡后二氧化碳的为0.25mol/L,物质的量为0.25mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
反应速率v(H2)=$\frac{△c}{△t}$;
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强,反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡想吸热反应方向进行,增大压强平衡向气体体积减小的方向进行;
(3)图象中1600°C减少的为二氧化碳,平衡体积分数为40%,结合化学平衡三行计算列式计算得到;
(4)Zn在阳极上失电子生成锌离子,Pb电极上CO2得电子生成C2O42-.
解答 解:(1)已知:①C(s)+H2O(g)?CO(g)+H2(g)△H1=+131.3KJ/mol
②C(s)+2H2O(g)?CO2(g)+2H2(g)△H2=+90.0kJ/mol
③CO2(g)+H2(g)?CO(g)+H2O(g)△H3
盖斯定律计算①-②得到CO2(g)+H2(g)?CO(g)+H2O(g)△H3=+41.3kJ/mol,
在反应①的体系中加入催化剂,催化剂改变化学反应速率不改变化学平衡,反应的△H1不变,
故答案为:+41.3;不变;
(2)①结合化学平衡三行计算列式计算,向1L 的恒容密闭容器中充入1molCO2(g)和3mol H2(g),测得CO2(g)和CH3OH(g)浓度随时间的变化如图1 所示,N起始量为1.00mol/L为二氧化碳,平衡后二氧化碳的为0.25mol/L,物质的量为0.25mol,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.75 2.25 0.75 0.75
平衡量(mol) 0.25 0.75 0.75 0.75
反应速率v(H2)=$\frac{△c}{△t}$=$\frac{\frac{2.25mol}{1L}}{8min}$=0.28mol/(L•min);
故答案为:CO2;0.28;
②在一定条件下,体系中CO2的平衡转化率(α)与L和X的关系如图2 所示,L和X分别表示温度或压强,反应为气体体积减小的放热反应,利用平衡影响原理分析,升温平衡想吸热反应方向进行,增大压强平衡向气体体积减小的方向进行,图象可知X增大CO2的平衡转化率(α),说明平衡正向进行则X为增大压强,L为温度变化,温度升高平衡逆向进行,二氧化碳转化率越大,温度越低,则L1<L2,
故答案为:压强;<;
(3))向一体积为20L的恒容密闭容器中通入1molCO2发生反应2CO2(g)═2CO(g)+O2(g),在不同温度下各物质的体积分数变化如图3所示.图象中1600°C减少的为二氧化碳,平衡体积分数为40%,1600℃时反应达到平衡,
设二氧化碳消耗浓度为x,
2CO2(g)═2CO(g)+O2(g)
起始量(mol/L) 0.05 0 0
变化量(mol/L) x x 0.5x
平衡量(mol/L) 0.05-x x 0.5x
$\frac{0.05-x}{0.05-x+x+0.5x}$=40%
x=0.025mol/L
平衡常数K=$\frac{0.025×0.5×0.02{5}^{2}}{(0.05-0.025)^{2}}$=0.0125,
故答案为:0.0125;
(4)利用电化学还原CO2制取ZnC2O4,则Zn失电子,所以Zn在阳极上失电子生成锌离子,即锌与正极相连为阳极;Pb电极上CO2得电子生成C2O42-,则其电极反应为:2CO2+2e-=C2O42-;
故答案为:阳;2CO2+2e-=C2O42-.
点评 本题考查了盖斯定律的计算、反应速率的计算、化学平衡的有关计算、电解原理的应用等,题目综合性较强,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,注意把握有关计算方法以及电解原理.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氯气与足量水反应,转移电子数目为1.5NA | |
| B. | 20gH218O中含有的质子数为10NA | |
| C. | 12g金刚石中含有的共价键数为2NA | |
| D. | 标准状况下,33.6L氟化氢中含有氟原子的数目大于1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
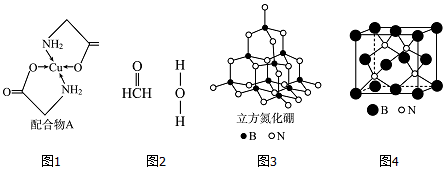
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
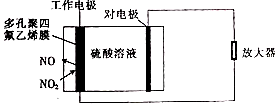 环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )
环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法不正确的是( )| A. | “对电极”是负极 | |
| B. | “工作电极”上发生的电极反应为NO2+2e-+2H+═NO+H2O | |
| C. | 传感器工作时H+由工作电极移向对电极 | |
| D. | 对电极的材料可能为活泼金属锌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C$\frac{\underline{\;←\;}}{\;}$O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1076 | 465 | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸乙酯的水解反应在碱性条件下比在酸性条件下水解更容易 | |
| B. | 油脂的水解可得到甘油,称为皂化反应 | |
| C. | 蛋白质水解的最终产物均为葡萄糖 | |
| D. | 淀粉水解和纤维素水解得到的最终产物相同,它们是同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com