
| A. | 115号元素衰变成113号元素是化学变化 | |
| B. | 核素${\;}_{115}^{289}X$中中子数与质子数之差为174 | |
| C. | 113号元素最高正价应为+3 | |
| D. | 115号与113号元素的原子质量比为115:113 |
分析 A.化学变化中原子保持不变;
B.中子数=质量数-质子数;
C.根据113号元素在周期表中的位置以及同主族元素性质的递变规律来回答;
D.元素的原子序数=核外电子数=核电荷数≠原子质量.
解答 解:A.化学变化中原子保持不变,115号元素衰变成113号元素有新的原子生成,不是化学变化,故A错误;
B.核素${\;}_{115}^{289}X$中中子数=质量数-质子数=289-115=174,则中子数与质子数之差为174-115=59,故B错误;
C.113号元素在周期表中的第7周期,第ⅢA主族,最高正价是+3价,故C正确;
D.元素的原子序数≠元素的原子质量,所以115号与113号元素的原子质量比不等于质子数之比,即不等于115:113,故D错误.
故选C.
点评 本题考查学生有关元素和核素相关概念的知识,要求学生熟记教材知识,注意相关知识之间的联系,灵活运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 改变条件 | 平衡移动方向 | pH | 水电离出的c(H+) | KW |
| 升温 | ||||
| 通入HCl气体 | ||||
| 加入NaOH固体 | ||||
| 加入NH4Cl固体 | ||||
| 加入金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 g氖气所含原子数为6.02×1023 | |
| B. | 25℃时,pH=6的水溶液中c(H+)>c(OH-) | |
| C. | 实验室制氢气时加入少量CuSO4可加快反应速率是利用了盐类的水解 | |
| D. | 把16.0 g无水硫酸铜粉末放在足量饱和硫酸铜溶液中会析出25.0 g晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
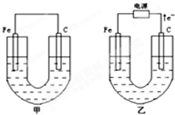 甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.12mol/(L•min) | B. | 0.06mol/(L•min) | C. | 0.08mol/(L•h) | D. | 0.12mol/(L•h) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在50 mL量筒中配制0.100 0 mol/L碳酸钠溶液 | |
| B. | 仅用烧杯、量筒、玻璃棒就可配制100 mL、0.100 0 mol/L K2Cr2O7溶液 | |
| C. | 用100 mL容量瓶、烧杯、玻璃棒、量筒、胶头滴管和pH=1的盐酸配制100 mL、pH=2的盐酸 | |
| D. | 配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余液体吸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com