
| A. | 某条件下可逆反应达到限度之前,逆反应速率逐渐增大可能与生成物浓度逐渐增大有关 | |
| B. | 可逆反应的限度不随反应条件的改变而改变 | |
| C. | 化学反应的限度决定了反应物在该条件下的最大转化率 | |
| D. | 炼铁高炉尾气中CO含量不随高炉高度改变而改变,是因为有关反应达到了限度 |
分析 一般来说,达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,反应物在平衡状态下的转化率最大,产物的产率最高,化学平衡会随温度、压强、催化剂等条件的改变而改变,以此解答该题.
解答 解:A、某条件下可逆反应达到限度之前,生成物浓度逐渐增大,正逆反应速率都会加快,即逆反应速率逐渐增大可能与生成物浓度逐渐增大有关,故A正确;
B、可逆反应的限度会随反应条件:温度、压强、催化剂等条件的改变而改变,故B错误;
C、反应物在平衡状态下的转化率最大,产物的产率最高,故C正确;
D、有关反应达到了平衡状态,各组分的含量不会随着时间的改变而变化,故D正确.
故选B.
点评 本题考查较为综合,涉及平衡状态和化学反应素的影响因素,为高频考点,侧重于学生的分析能力和基本概念、理论知识的综合理解和运用的考查,难度不大,注意相关基础知识的积累.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

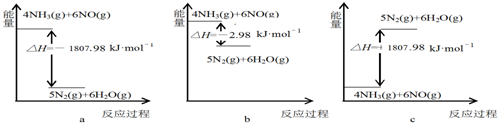
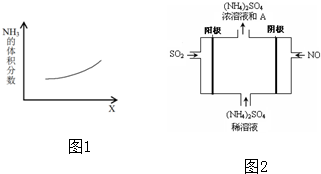
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸反应,又能与碱反应 | |
| B. | 导电性好 | |
| C. | 熔点低 | |
| D. | 具有还原性,在冶炼反应中放出大量的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
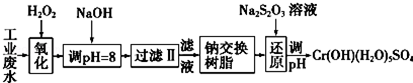
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同的粉末状和块状的MnO2分别加入盛有15ml 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
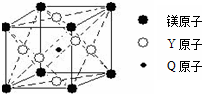 Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:
Q、R、T、X、Y、Z是六种原子序数依次增大的前四周期常见元素,其相关信息如表:| 元素 | 相关信息 |
| Q | Q的单质是实验室常用的惰性电极材料 |
| R | R原子基态时2p原子轨道上有3个未成对电子 |
| T | 负二价的元素T的氢化物在通常情况下是一种液体,且 T的质量分数为88.9% |
| X | X是第三周期电负性最大的元素 |
| Y | 元素Y位于周期表第10列 |
| Z | Z存在质量数为65,中子数为36的核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 根据酸分子中含有氢原子的个数,将酸分为一元酸、二元酸等 | |
| B. | 根据化合物在溶液中电离出的离子的类别,将化合物分为酸、碱、盐 | |
| C. | 根据化学反应中有无单质参加或生成,将化学反应分为氧化还原反应和非氧化还原反应 | |
| D. | 四种基本反应类型未能包括所有的化学反应,酸性氧化物、碱性氧化物、两性氧化物的分类包括了所有的氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂、纤维素、淀粉都是高分子化合物 | |
| B. | 煤的干馏、蛋白质的变性和纳米银粒子的聚焦都是化学变化 | |
| C. | 酒精、甲苯、四氯化碳都能萃取碘水中的碘单质 | |
| D. | 乙烯、乙炔都可作为合成聚合物的单体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com