
【题目】在元素周期表中,元素性质随原子序数的递增呈现周期性变化的本质原因是( )
A.中子数逐渐增多
B.相对原子质量逐渐增大
C.核外电子排布呈现周期性变化
D.元素化合价呈现周期性变化
科目:高中化学 来源: 题型:
【题目】(1)发射卫星用N2H4为燃料,NO2为氧化剂,两者反应生成N2和水蒸气, 已知
N2(g)+2O2(g)=2NO2(g) ⊿ H1= + 67.7kJ/mol;
N2H4(g)+O2(g)= N2(g)+2H2O(g) ⊿ H2= - 534kJ/mol;
2H2(g)+ O2(g)= 2H2O (g) ⊿ H3= - 484kJ/mol;
H2(g)+F2(g)=2HF(g) ⊿ H4= - 538kJ/mol
①写出N2H4与 NO2反应的热化学方程式______________________,
②写出N2H4与F2反应的热化学方程式__________________________
(2)已知反应:Cl2+2HBr===Br2+2HCl。
Ⅰ.当有0.2 mol HCl生成时放出8.1 kJ的热量。
Ⅱ.其能量变化示意图如图:

由上述数据判断断开1 mol H—Cl 键与断开 1 mol H—Br键所需能量相差约为________kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带含有丰富的碘。为了从海带中提取碘,某学习小组设计并进行了以下实验:

(1)海带提碘实验中不需要的仪器是_________(选填编号)。
A.![]() B.
B.![]() C.
C.![]() D.
D. ![]()
(2)步骤③的实验操作名称是____________;用到的玻璃仪器有(写仪器名称)_____________________________________。
(3)步骤④反应的离子方程式是__________________________________。
(4)步骤⑤是用有机溶剂将碘从水中提取出来,此过程包含的实验操作是_______________、_______________。不能用酒精代替苯的理由是_________________________(用文字简述)。
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法(用文字简述):_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系式错误的是( )
A. CO2的水溶液:c(H+)>c(HCO3-)>2c(CO32-)
B. 等浓度的HCN溶液与NaOH溶液等体积混合,所得溶液pH>7,则溶液中离子浓度:c(Na+)>c(CN-) >c(OH-)>c(H+)
C. NaHCO3溶液中存在水解平衡:HCO3-+H2OH2CO3+OH-
D. 两种弱酸HX和HY混合后,溶液中的c(H+)为(Ka为电离平衡常数) ![]() +
+![]() + c(OH-)
+ c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂以重晶石(主要含BaSO4)为原料,生产“电子陶瓷工业支柱”—钛酸钡(BaTiO3)![]() 的工艺流程如下:
的工艺流程如下:
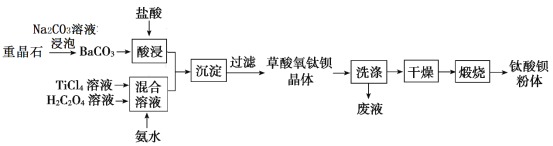
已知:
(1)Ksp(BaSO4)=1.0×10﹣10 ,Ksp(BaCO3)=5.0×10-9
(2)草酸氧钛钡晶体的化学式为 BaTiO(C2O4)2·4H2O
回答下列问题:
(1)为提高BaCO3的酸浸速率,可采取的措施为_________(写出一条)。
(2)配制一定浓度的TiCl4溶液时,通常是将TiCl4(室温下为液体)________________。
(3)用Na2CO3溶液泡重晶石(假设杂质不与Na2CO3溶液作用),待达到平衡后,移走上层清液,重复多次操作,将BaSO4转化为BaCO3,此反应的平衡常数K=______(填写计算结果)。若不考虑CO32-的水解,则至少需要使用浓度为_____mol/LNa2CO3溶液浸泡重晶石才能开始该转化过程。
(4)设计实验方案验证草酸氧钛钡晶体已经洗涤干净:______________________________。
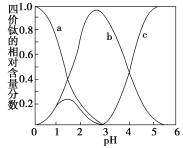
(5)“混合溶液液”环节,钛元素在不同pH下主要以TiOC2O4、TiO(C2O4)22-和TiO(OH)+三种形式存在,如图所示。实际制备工艺中,先用氨水调节混合溶液的pH于2.5~3之间,再进行“沉淀”,则图中曲线a对应钛的形式为_____(填化学式);写出“沉淀”时的离子方程式:___________。
(6)煅烧草酸氧钛钡晶体得到BaTiO3方程式为:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的保存方法,与其化学性质无关的是( )
A.金属钠保存在煤油中
B.浓盐酸需密闭保存
C.新制氯水密闭存放于棕色瓶中
D.过氧化钠需保持干燥密闭保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质分离方法的叙述中,不正确的是 ( )
A.用过滤的方法分离溶液和胶体
B.用四氯化碳萃取碘水中的碘
C.用蒸馏的方法将自来水制成蒸馏水
D.用加热的方法分离氯化钠和氯化铵固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和硝酸都是重要的工业原料。
(1)标准状况下,将500 L氨气溶于水形成1 L氨水,则此氨水的物质的量浓度为__mol· L-1(保留三位有效数字)。工业上常用过量氨水吸收二氧化硫,该反应的化学方程式为__。
(2)氨氧化法是工业生产中合成硝酸的主要途径。合成的第一步是将氨和空气的混合气通过灼热的铂铑合金网,在合金网的催化下,氨被氧化成一氧化氮,该反应的化学方程式为__。
下列反应中的氨与氨氧化法中的氨作用相同的是__。
A.2Na+2NH3===2NaNH2+H2↑ B.2NH3+3CuO===3Cu+N2+3H2O
C.4NH3+6NO===5N2+6H2O D.HNO3+NH3===NH4NO3
工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH﹣===NO2-+NO3-+H2O和NO+NO2+2OH﹣===□ +H2O(配平该方程式)。______________
(3)向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
①Cu与稀HNO3反应的离子方程式为__。
②Cu与Cu2O 的物质的量之比为__。
③HNO3的物质的量浓度为__mol·L-1。
(4)有H2SO4和HNO3的混合溶液20 mL,加入0.25 molL﹣1Ba(OH)2溶液时,生成沉淀的质量w(g)和Ba(OH)2溶液的体积V(mL)的关系如图所示(C 点混合液呈中性)。则原混合液中H2SO4的物质的量浓度为__mol·L-1,HNO3的物质的量浓度为__mol·L-1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠的化合物用途广泛,回答下列问题:
(1)多硫化钠(Na2Sx)用作聚合的终止剂。钠原子价层电子的轨道表达式(电子排布图)为___________,基态S原子电子占据最高能级的电子云轮廓图为___________,其中Na2S4中存在的化学键有:___________。
A.离子键 B.极性共价键 C.π键 D.非极性共价键
(2)r(S2-)>r(Na+)的原因是___________。
(3)Na2SO3常用作工业的脱氧剂和漂白剂,其阴离子的中心原子的杂化形式是___________,空间构型是______________________。
(4)下表列出了钠的卤化物的熔点:
化学式 | NaF | NaCl | NaBr | NaI |
熔点/℃ | 995 | 801 | 775 | 651 |
①NaF的熔点比NaI的熔点高的原因是_________________________________;
②NaCl晶格能是786 kJ/mol,则NaF的晶格能可能是___________。
A. 704 kJ/mol B. 747kJ/mol C 928 kJ/mol
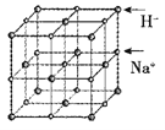
(5)NaH具有NaCl型的立方晶体结构,已知NaH晶体的晶胞参数a=488pm,Na+半径为102pm,则H-的半径为___________pm;NaH的理论密度是___________g·cm-3(保留三位有效数字)。[H—1、Na—23]
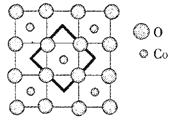
(6)首例被发现的带结晶水的超导材料晶体化学式为Na0.35CoOx·1.3H2O,具有……-CoO2-H2O-Na-H2O-CoO2-H2O-Na-H2O-……层状结构,已知CoOx层的构型部分如图,其中粗线画出的是其二维晶跑,则x=___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com