
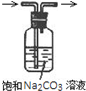
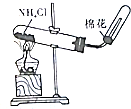
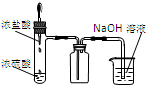
| A.装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 | B.装置可除去CO2中含有的少量HCl | C.装置可制备氨气 | D.装置可制取、收集并吸收多余的HCl |
 |  |  |  |
| A. | A | B. | B | C. | C | D. | D |
分析 A.蔗糖脱水碳化,会发生氧化还原反应生成二氧化硫,品红溶液褪、酸性高锰酸钾溶液分别验证漂白性、还原性;
B.碳酸钠溶液会吸收二氧化碳;
C.氯化铵受热易分解,在温度较低时又重新生成氯化铵;
D.吸收HCl需要防止倒吸.
解答 解:A.A.蔗糖脱水碳化,会发生氧化还原反应生成二氧化硫,体现浓硫酸的脱水性、强氧化性,品红溶液褪色说明二氧化硫具有漂白性,酸性高锰酸钾溶液褪色说明二氧化硫具有还原性,故A正确;
B.碳酸钠溶液会吸收二氧化碳,应改用饱和的碳酸氢钠溶液,故B错误;
C.氯化铵受热易分解生成氨气与HCl,在温度较低时又重新生成氯化铵,不能只用氯化铵制备氨气,实验室用氢氧化钙和氯化铵在加热条件下制备氨气,故C错误;
D.尾气处理需要连接倒置的漏斗,以防止倒吸,且HCl极易溶于水,不需要用NaOH溶液吸收,用水吸收即可,故D错误.
故选:A.
点评 本题考查化学实验方案评价,涉及性质探究、除杂、氨气制备、尾气处理等,题目难度不大,B选项为易错点,学生容易根据碳酸钠可以吸收HCl解答,忽略HCl的含量较少.


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:选择题
| A. | 从阴离子HS-电离出H+比从H2S电离出H+更难 | |
| B. | H2S电离出的H+会抑制HS-的电离 | |
| C. | 溶液中c(H+)与c(HS-)接近于相等且c(H+)略大于c(HS-) | |
| D. | 溶液中c(H+)=2c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 通入Cl2后,装置Ⅰ中发生了氧化还原反应 | |
| B. | Cl2与Na2SO3溶液反应的离子方程式是:SO32-+Cl2+H2O=SO42-+2Cl-+2H+ | |
| C. | 导气管末端不应该伸入到液面以下 | |
| D. | 若将装置Ⅰ中Na2SO3改成NaOH溶液,现象完全相同 |
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:填空题
镍(28Ni)金属羰基化合物[金属元素和一氧化碳(CO)中性分子形成的一类配合物]、金属储氢材料[能可逆的多次吸收、储存和释放氢气(H2)的合金]等领域用途广泛。
(1)Ni原子基态核外电子排布式为_________________。
(2)Ni(CO)4中镍的化合价为_____________,写出与CO互为等电子体的中性分子、带一个单位正电荷的阳离子、带一个单位负电荷的阴离子各一个:__________、_____________、___________。

(3)一种储氢合金由镍与镧(La)组成,其晶胞结构如图所示.则该晶体的化学式为_________。
(4)下列反应常用来检验Ni2+,请写出另一产物的化学式__________。
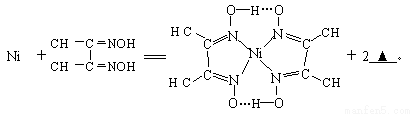
与Ni2+配位的N原子有_________个,该配合物中存在的化学键有__________(填序号)。
A共价键 B离子键 C配位键 D金属键 E氢键
查看答案和解析>>
科目:高中化学 来源:2017届湖北省荆门市高三上九月联考化学试卷(解析版) 题型:选择题
燃料电池具有能量转化率高无污染等特点,如图为Mg—NaClO燃料电池结构示意图。下列说法正确的是( )

A.镁作Y电极
B.电池工作时Na+向负极移动
C.废液的pH大于NaClO溶液的pH
D.X电极上发生的反应为:ClO-+2H2O-4e-=ClO3-+4H+
查看答案和解析>>
科目:高中化学 来源:2017届河南省开封市高三上学期10月定位考试化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数值。下列有关叙述正确的是
A.1 molN2与4 mol H2反应生成的NH3分子数为2NA
B.2.4g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,2.24L的CCl4中含有的C—Cl键数为0.4NA
D.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com