
【题目】化合物G是一种药物合成中间体,其合成路线如下:

⑴下列说法正确的是______。
A.可以用NaHCO3溶液鉴别化合物A和G
B.有机物A分子中只含有2个手性碳原子
C.化合物B分子中所有碳原子可能位于同一平面
D.1 mol化合物E最多可与1 mol NaOH反应
⑵反应②的反应类型是______。
⑶化合物F的结构简式是______。
⑷写出一种满足下列条件的C的同分异构体的结构简式:______。
Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应;Ⅲ.分子含5种不同化学环境的氢。
【答案】AD 加成反应 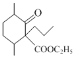
![]()
【解析】
有机物A(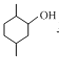 )在酸性条件下被高锰酸钾氧化生成B(
)在酸性条件下被高锰酸钾氧化生成B(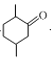 ),
), 在碱性条件下与甲醛发生加成反应生成
在碱性条件下与甲醛发生加成反应生成 ,酸性条件下被高锰酸钾氧化生成D,根据D与乙醇发生酯化生成E(
,酸性条件下被高锰酸钾氧化生成D,根据D与乙醇发生酯化生成E(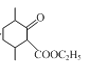 ),则D的结构式为
),则D的结构式为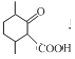 ;
;  在乙醇和乙醇钠混合液的环境中与1-溴丙烷发生取代反应生成F(
在乙醇和乙醇钠混合液的环境中与1-溴丙烷发生取代反应生成F( ),
), 在酸性或碱性条件下水解生成G(
在酸性或碱性条件下水解生成G(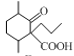 )。
)。
⑴A.A为 含有醇羟基,不与NaHCO3溶液反应,G为
含有醇羟基,不与NaHCO3溶液反应,G为 ,含有羧基,与NaHCO3溶液反应生成二氧化碳气体,则可以鉴别化合物A和G,故A正确;
,含有羧基,与NaHCO3溶液反应生成二氧化碳气体,则可以鉴别化合物A和G,故A正确;
B.有机物A为 ,分子中含有3个手性碳原子,故B错误;
,分子中含有3个手性碳原子,故B错误;
C.化合物B为 ,分子中所有碳原子单键相连,不可能位于同一平面,故C错误;
,分子中所有碳原子单键相连,不可能位于同一平面,故C错误;
D.E为 ,结构中含有一个酯基,则1 mol化合物E最多可与1 mol NaOH反应,故D正确;
,结构中含有一个酯基,则1 mol化合物E最多可与1 mol NaOH反应,故D正确;
答案选AD。
⑵根据分析, 在碱性条件下与甲醛发生加成反应生成
在碱性条件下与甲醛发生加成反应生成 反应②的反应类型是加成反应。
反应②的反应类型是加成反应。
答案为:加成反应。
⑶根据流程分析,化合物F的结构简式是 。
。
答案为: ;
;
⑷C的结构式为 ,与C互为同分异构体,并满足Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应,说明该结构具有醛的结构和酯的结构,分子中只有2个氧原子,因此为甲酸酯;Ⅲ.分子含5种不同化学环境的氢的条件,故该物质的结构式为
,与C互为同分异构体,并满足Ⅰ.含有六元环;Ⅱ.能发生银镜反应和水解反应,说明该结构具有醛的结构和酯的结构,分子中只有2个氧原子,因此为甲酸酯;Ⅲ.分子含5种不同化学环境的氢的条件,故该物质的结构式为![]() 。
。
答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】含有a mol FeI2的溶液中,通入x mol Cl2。下列各项为通入Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A. x≤a,2I+Cl2=I2+2Cl
B. x=1.2a,10Fe2++14I+12Cl2=10Fe3++7I2+24Cl
C. x=1.4a,4Fe2++10I+7Cl2=4Fe3++5I2+14Cl
D. x≥1.5a,2Fe2++4I+3Cl2=2Fe3++2I2+6Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应NH4Cl+NaNO2![]() NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
NaCl+N2↑+2H2O放热且产生气体,可用于冬天石油开采。下列表示反应中相关微粒的化学用语正确的是
A. 中子数为18的氯原子:![]()
B. N2的结构式:N=N
C. Na+的结构示意图: 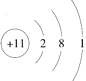
D. H2O的电子式: ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按要求写出相应的方程式
⑴某小组同学合作探究铝铁混合物分离的工艺流程如下图甲:


图甲 图乙
①气体A能使湿润的红色石蕊试纸变蓝,则加热时“反应1”的离子方程式为______(用单线桥标出反应电子转移的方向和数目)。
②“反应2”的离子方程式为______。
③气体A能发生如图乙所示的转化,该转化的总反应的化学方程式为______。
⑵由工业废气制备Na2S2O4的实验原理如下:

①“氧化”时Ce(SO4)2转化为Ce2(SO4)3,NO气体转化为HNO2和HNO3,产物中HNO2和HNO3物质的量之比为3∶1,写出“氧化”反应的化学方程式:______。
②写出“电解”反应的离子方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组以环己醇![]() 制备环己烯。已知:
制备环己烯。已知:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | ﹣103 | 83 | 难溶于水 |
(1)制备粗品将12.5 mL环己醇加入试管A中,再加入1 mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
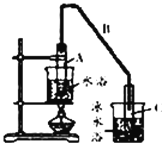
①写出环己醇制备环己烯的化学反应方程式:_________。
②A中碎瓷片的作用是_____________,导管B除了导气外还具有的作用是_____________。
③试管C置于冰水浴中的目的是_______________________。
(2)环己烯粗品中含有环己醇和少量酸性杂质等,需要提纯。
①加入饱和食盐水,振荡、静置、分层,水在______层(填上或下);分液后用_________(填入编号)洗涤。
a.KMnO4溶液 b.稀 H2SO4 c.Na2CO3溶液
②再将环己烯热馏,蒸馏时要加入生石灰,目的是__________。
③收集产品时,控制的温度应在_________左右。
(3)以下区分环己烯精品和粗品的方法,合理的是_______。
a.用酸性高锰酸钾溶液 b.用金属钠 c.溴水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 仅用水不能区分已烷、溴乙烷、乙醇三种液态有机物
B. 碳原子数小于或等于6的单烯烃,与HBr加成反应的产物只有1种结构,符合条件的单烯烃有3种
C. 苯、乙烷、乙烯、乙炔分子中碳碳键的键长分别为a、b、c、d,则![]() >d
>d
D. 等质量的烃完全燃烧,耗氧量最多的是甲烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:A.Zn+H2SO4=ZnSO4+H2↑;B.NaOH+HCl=NaCl+H2O。能设计成原电池的反应是__________(填“A”或“B”)。
(2)将锌片和铜片按如图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置
B.甲中铜片质量减少、乙中锌片质量减少
C.两烧杯中溶液的c(H+)均减小
②在相同时间内,两烧杯中产生气泡的速度:甲__________乙(填“>”、“<”或“=”)。
③请写出图中构成原电池的正极电极反应式:__________。
④当乙中产生2.24 L(标准状况)气体时,将锌铜片取出,再将烧杯中的溶液稀释至1 L,测得溶液中c(H+)=0.2 mol·L-1(设反应前后溶液体积不变)。试确定原稀硫酸的物质的量浓度为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面的排序不正确的是
A. 晶体的熔点:![]() >
>
B. 晶格能的大小: Al2O3>MgCl2>NaCl
C. 共价键的键长: F-F>C-Cl>C-S>Si-O
D. 硬度由大到小:金刚石>氮化硅>晶体硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com