
| 原子 | N | S | O | Si |
| 半径r/10-10m | 0.75 | 1.02 | 0.74 | 1.17 |
科目:高中化学 来源:不详 题型:单选题
| 元素代号 | X | Y | Z | W | N |
| 原子半径/nm | 0.186 | 0.074 | 0.102 | 0.099 | 0.160 |
| 主要化合价 | +1 | -2 | -2、+6 | +7、-1 | +2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-1 | B.+2 | C.+3 | D.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
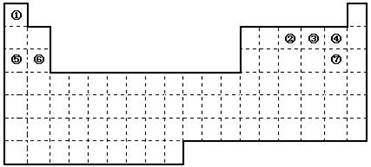

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 和
和 的电子层结构相同,则下列说法中不正确的是
的电子层结构相同,则下列说法中不正确的是A.Y元素的核电荷数 等于 等于 |
| B.Y的原子序数小于X的原子序数 |
C. 的离子半径小于 的离子半径小于 的离子半径 的离子半径 |
D.若X元素位于 周期,则Y元素位于 周期,则Y元素位于 周期 周期 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.a>b>c>d | B.a>c>d>b |
| C.c>a>b>d | D.b>d>c>a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com